
AmBeed文献解读|J. Agric. Food Chem.
抑制黄曲霉生长和减少黄曲霉毒素污染的花生种皮次生代谢物的鉴定和表征

2024年10月16日,得克萨斯农工大学Venugopal Mendu课题组在Journal of Agricultural and Food Chemistry(IF=5.7)发表文章《Identification and Characterization of Peanut Seed Coat Secondary Metabolites Inhibiting Aspergillus flavus Growth and Reducing Aflatoxin Contamination》,这篇文章主要鉴定和表征了花生种皮中的次生代谢物,这些代谢物能够抑制黄曲霉菌(Aspergillus flavus)的生长并减少黄曲霉菌(aflatoxin)的污染。研究内容涉及了对花生种皮的代谢分析,以及对特定代谢物的筛选和测试,以评估它们对黄曲霉菌生长和黄曲霉毒素产生的抑制效果。
花生,学名Arachis hypogaea L.,黄曲霉毒素在花生中的污染可能导致肝脏、肾脏和消化系统功能异常等健康问题。花生种皮是贮存次生代谢物的储存库,这些次级代谢物被策略性地储存在植物组织中,以抵御病原体和非生物胁迫。在花生种皮中多种次级代谢物包括黄酮类、苯甲酸衍生物、羟基肉桂酸衍生物、香豆素、萜类、茋类和酚类化合物。这些次级代谢物中的绝大多数是通过苯丙烷途径合成的。
本研究旨在鉴定和表征花生种皮中能够抑制曲霉菌生长和减少黄曲霉毒素污染的代谢物。研究选取了在充分灌溉和缺水条件下生长的花生品种,对其进行了抗曲霉菌活性测试,并通过液相色谱-质谱技术对种皮的代谢物进行了分析。利用京都基因和基因组百科全书(KEGG)的苯丙烷途径数据库进行参考分析,成功鉴定出多种种皮代谢化合物。
进一步筛选出10种代谢物,对其抑制曲霉菌生长和黄曲霉毒素污染的能力进行了测试。通过径向生长生物测定法发现,2,5-二羟基苯甲醛能显著抑制曲霉菌的生长(抑制率达98.7%),并将黄曲霉毒素污染量从994微克/千克降低至1微克/千克。扫描电子显微镜图像显示,2,5-二羟基苯甲醛处理的曲霉菌培养物中菌丝和分生孢子结构出现扭曲变形,这表明该化合物不仅有望应用于田间,还可用于种皮代谢工程,以增强花生对曲霉菌的抗性。
结果
对不同种子等级(大小)的6个花生品种在充分灌溉(WW)和干旱条件下(WD)条件下的黄曲霉定殖率进行了评价。深入分析表明,在WD条件下种植的花生更容易被曲霉菌(A. flavus)定殖,相较于WW条件的花生,其定殖率更高(图1)。在所研究的四个不同等级的花生种子中,ELK等级的种子在两种灌溉条件下曲霉菌的定殖率均为最低,而peewees等级的种子定殖率最高(图2)。

图1 在WD和WW条件下生长的不同等级花生种子的体外定殖(IVSC)测定
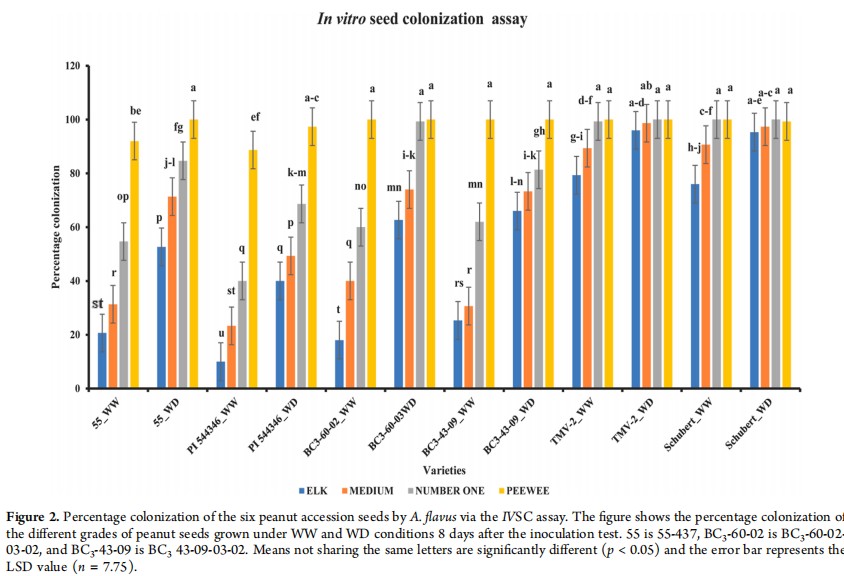
图2 用IVSC法测定6种花生入种种子的定殖率
基于黄曲霉的定殖,主成分分析(PCA)用于确定三组花生品种(A组:栽培抗性品种,B组:野生种衍生抗性品种,C组:栽培易感品种)中WW或WD条件下共有或特有代谢物组之间的显著差异(图3B)。相比之下,WD特有的172种代谢物的PCA在三组之间没有显着差异;然而,B组与A组、B组与C组之间存在差异(图3A)。对397种常见代谢物的PCA显示WW和WD条件之间存在显著差异,但三组品种之间的差异并不明显(图3C)。
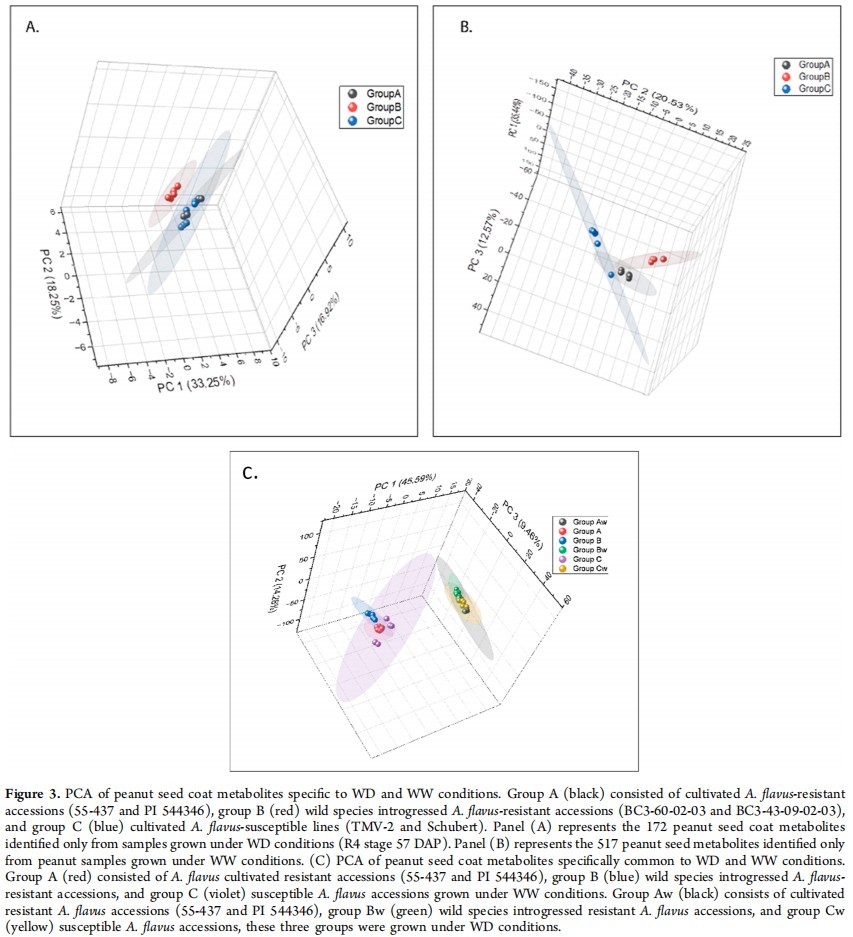
图3 在WD和WW条件下花生种皮代谢产物的主成分分析
在KEGG分析花生种皮中鉴定出的54种苯丙烷途径代谢物,仅在WW条件下鉴定出28种(图4C),其中10种是WD独有的(图4A),16种存在于两种条件下(图4B)。在三种灌溉条件(WW、WD和两者结合)下鉴定的苯丙烷途径代谢物的相对丰度显示,三组花生品种(栽培抗性、野生种衍生抗性和栽培易感)之间存在显著差异(p<0.001)。在这两种条件下鉴定的苯丙烷途径代谢物在WD条件下的相对丰度高于WW代谢物(图4B)。
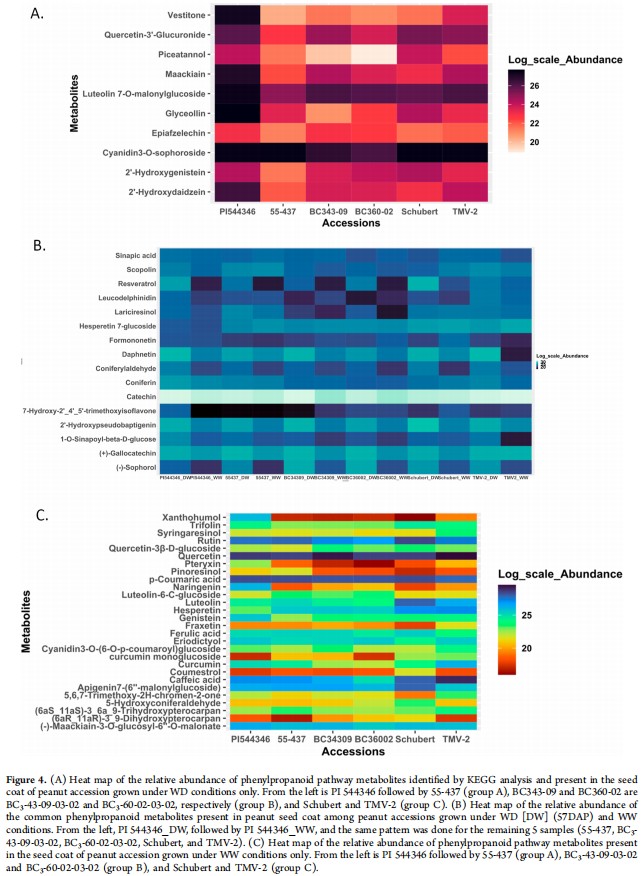
图4 通过比较研究鉴定花生种皮中控制黄曲霉抗性的推测苯丙烷途径代谢产物
通过对比抗性和易感性品种时,54种苯丙烷途径代谢物中有17种被选为花生种皮中黄曲霉(A. flavus)抗性的潜在贡献者。通过比较最强的曲霉菌抗性品种(PI 544346)与C组(包括TMV-2和Schubert等敏感品种)品种,发现柚皮素(naringenin)和黄腐酚(xanthohumol)在抗性品种中的表达量变化倍数差异最大(表1)。
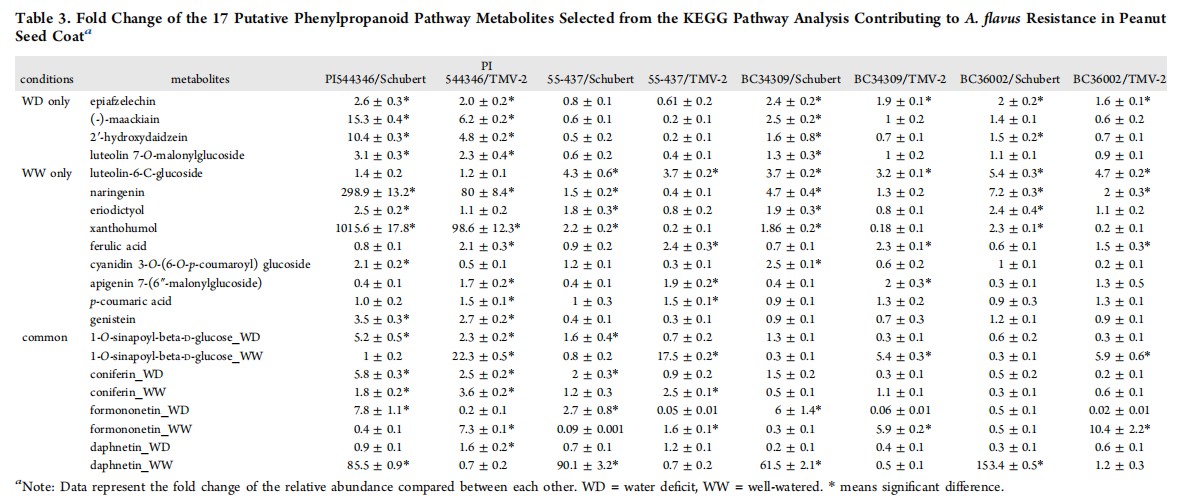
表1 KEGG途径筛选的17个对花生种皮黄曲霉产生抗性的苯丙烷途径代谢物的影响
从KEGG途径分析中选出的17种苯丙烷途径代谢物,以及使用PCA鉴定的30种代谢物,共产生了47种可能影响花生种皮中黄曲霉抗性的候选代谢物。作者从47种代谢物中选择了10种用于径向生长生物测定(表2)。这10种选定化合物的径向生长生物测定表明,在10mg/mL的浓度下,三种代谢物使黄曲霉的菌丝生长减少了50%以上(图5)。制霉菌素和2,5-二羟基苯甲醛对黄曲霉的抑制作用最高,均达到98%(图5和图6)。阿魏酸和对香豆酸也显著抑制了黄曲霉的生长,分别为76.5%和62.1%(图6)。
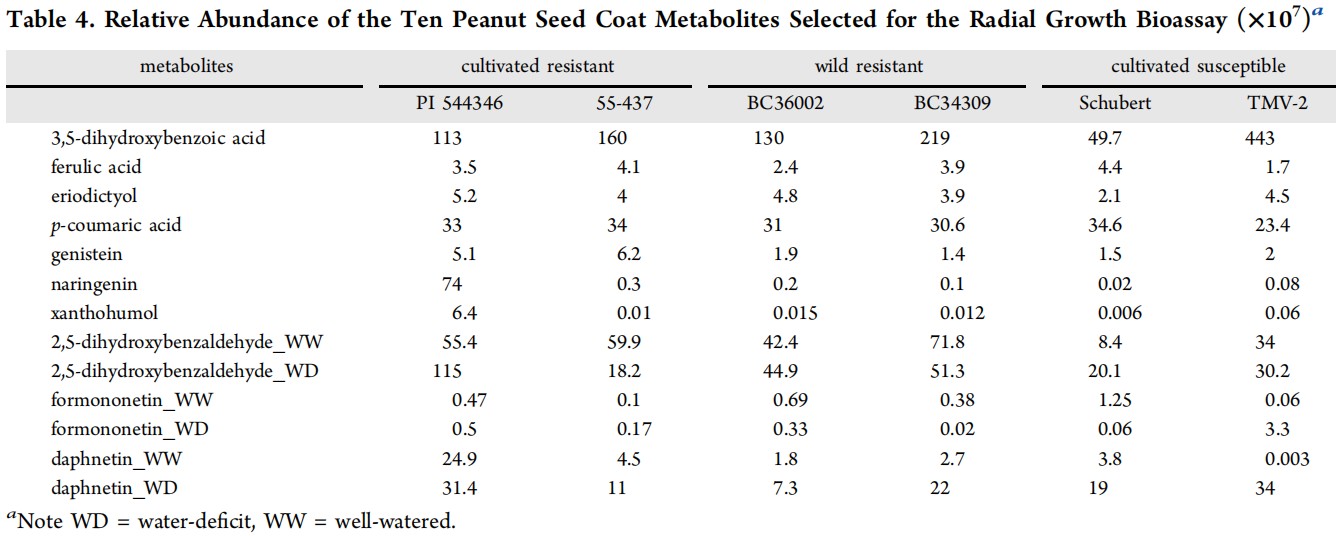
表2 径向生长生物测定选择的10种花生种皮代谢物相对丰度(×10 7 )a

图5 采用径向生长生物测定法评价了不同花生种皮代谢物对黄曲霉感染的抗真菌活性
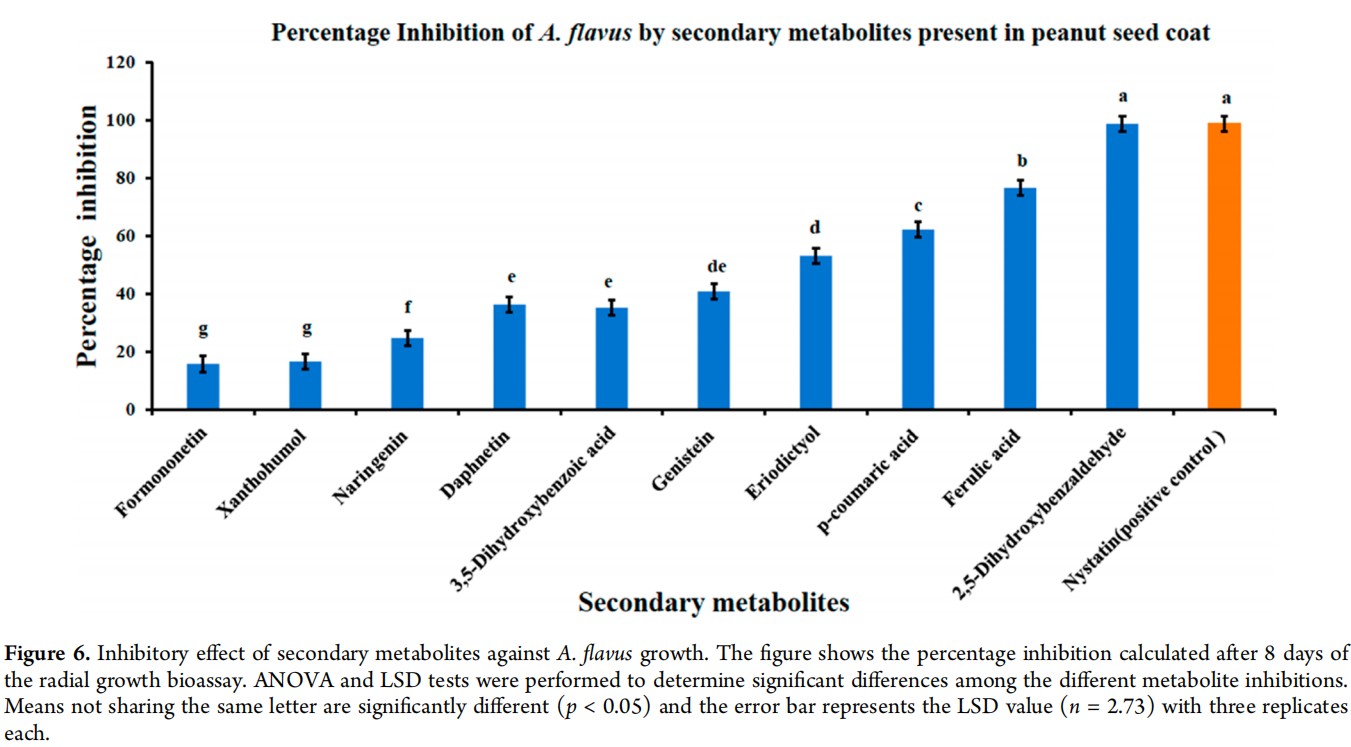
图6 次生代谢物对黄曲霉生长的抑制作用
作者利用扫描电子显微镜(SEM)来观察2,5-二羟基苯甲醛处理引起的结构变化。在未经处理的对照组(水中含50% DMSO)与经过代谢物处理的培养物之间,作者观察到了真菌形态的明显变化。在未经处理的对照组中,菌丝的特征是长、线性、管状且间隔均匀的菌丝结构(图7A),同时还有完整的分生孢子梗,上面承载着状态良好的分生孢子(图7B(2))和瓶梗(图7C(3))。成熟的分生孢子后来被分散,导致新分生孢子梗的形成。真菌的增殖导致菌丝网络的扩展,促进了在PDA培养基上的完全生长(图5A)。相反,在用2,5-二羟基苯甲醛(0.63 mg/mL)处理的菌丝中,观察到显著的形态变化。观察到扁平、卷曲和起泡的菌丝(图7D),以及结构被破坏的分生孢子梗(图7E),分生孢子和瓶梗都出现了变形,不易区分(图7F)。总体而言,2,5-二羟基苯甲醛通过改变菌丝、分生孢子梗和分生孢子的结构,抑制了曲霉菌的定殖,从而降低了真菌增殖和生长的能力。
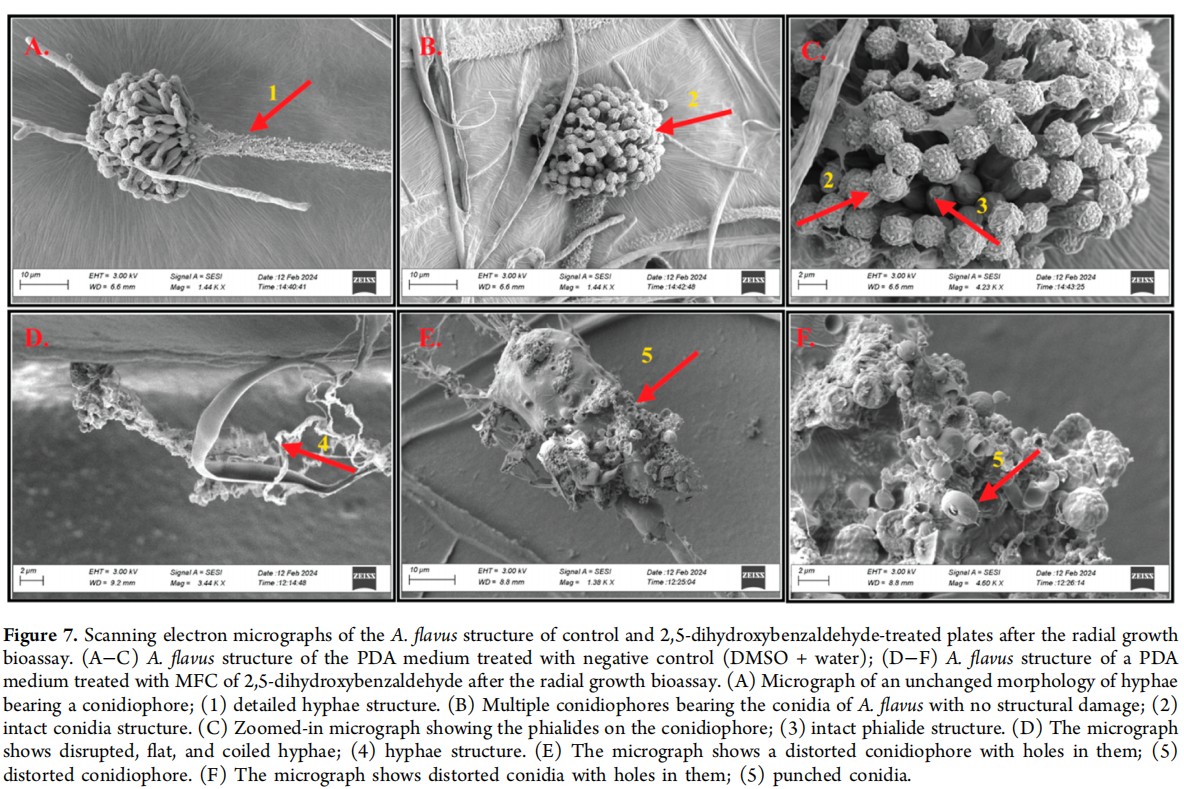
图7. 通过径向生长生物测定后,对照组和2,5-二羟基苯甲醛处理板的曲霉菌结构的扫描电子显微图。
这些发现表明了2,5-二羟基苯甲醛是一种有前景的抗真菌药物,也是培育抗黄曲霉花生品种的潜在生物标志物。总的来说,本研究证明了探索花生种皮代谢物作为管理黄曲霉和黄曲霉毒素污染策略的重要性,为培育抗黄曲霉花生品种提供了重要的代谢物和基因资源。

实验所用的3,5-Dihydroxybenzoic acid(CAS:99-10-5), 2,5-dihydroxybenzaldehyde(CAS:1194-98-5), xanthohumol(CAS:6754-58-1), naringenin(CAS:480-41-1), and daphnetin(CAS:486-35-1)均来自 AmBeed
Doi:10.1021/acs.jafc.4c05517













