
AmBeed文献解读|Neuron
细胞内蛋白质-脂质相互作用在神经连接蛋白募集之前驱动突触前组装

2025年1月,阿尔伯特·爱因斯坦医学院Peri T Kurshan发表题为《Intracellular protein- lipid interactions drive presynaptic assembly prior to neurexin recruitment》的研究。研究揭示了在秀丽隐杆线虫(C. elegans)中,突触前活性区的支架蛋白SYD-1通过与磷脂酰肌醇4,5-二磷酸(PIP2)的相互作用,先于神经节蛋白(Neurexin)到达突触前位点,并通过其C2和PDZ结构域与PIP2相互作用来定位。这一发现挑战了传统的突触形成模型,并提出了一个新的机制,即突触前结构的组装可以通过细胞内机制而非依赖于跨突触的细胞黏附分子相互作用来启动。
研究背景:
1. 突触是神经元之间信息传递的关键结构,其形成过程对神经系统功能至关重要。
2. 传统的突触形成模型认为,突触的形成是由跨突触的细胞黏附分子(CAMs)介导的,这些分子通过与对侧细胞的相互作用来招募突触前和突触后组分。
3. 然而,越来越多的证据表明,突触前和突触后的特化结构可以在没有跨突触信号的情况下形成,提示存在细胞内机制驱动的突触组装。
4. 众多研究证据表明位于神经元突触前末梢的支架蛋白SYD-1对于突触活性区域的形成至关重要(比如会通过液液相分离的方式促进突触前蛋白的聚合,从而有助于突触活性区域的形成),但是SYD-1对于突触组装的具体作用未知。
研究方法:
1. 模式生物:研究者使用了秀丽隐杆线虫(C. elegans)作为模型生物,因为它具有简单的神经系统和易于操作的遗传工具。
2. 基因编辑与突变体:通过CRISPR-Cas9技术,研究者生成了多个突变体,包括neurexin基因(nrx-1)的敲除突变体和SYD-1蛋白不同结构域的突变体。
3. 活体成像:利用荧光标记技术,研究者在活体线虫中观察了突触前蛋白的定位和聚集情况。
4. 分子动力学模拟:结合粗粒化和原子级分子动力学模拟,研究者预测了SYD-1蛋白的C2和PDZ结构域与PIP2相互作用的机制。
5. 生化验证:通过蛋白质-脂质覆盖实验验证了SYD-1 C2结构域与PIP2的相互作用。
AmBeed产品:
5-Ph-IAA(A1440350)
5-Ph-IAA是植物生长素 IAA 的衍生物,结合 OsTIR1 (F74G) 突变体用于建立生长素诱导的 degron 2 系统 (AID2),能够快速有效地降解 mAID 融合蛋白,常用于肿瘤研究。
在本篇文献中,5-Ph-IAA用于诱导PPK-1蛋白的降解,从而揭示了PIP2在突触前结构组装中的重要性。实验结果显示当PPK-1被5-Ph-IAA诱导降解后,突触前的SYD-1蛋白聚集显著减少,表明PPK-1(及其生成的PIP2)对SYD-1的突触前定位至关重要。
PPK-1是一种关键的酶,它在细胞内负责合成磷脂酰肌醇-4,5-二磷酸(PIP2)。PIP2是一种重要的膜磷脂,广泛参与细胞信号传导、细胞骨架动态、囊泡运输以及突触功能等生物学过程。
Auxin-inducible degradation system (AID):将一段短肽序列Degron和目的蛋白融合表达,然后在该细胞内表达E3连接酶TIR1(F79G变体),TIR1会识别并Degron标记的蛋白并诱导其泛素化和蛋白酶体降解,在此时加入植物激素或其类似物5-Ph-IAA可以促进TIR1与degron之间的相互作用,导致融合蛋白的快速泛素化和降解,实现目的蛋白的靶向降解。
产品在文献中的使用方式:在线虫的培养板(NGM plates seeded with OP50)中加入终浓度为50μM的5-Ph-IAA(DMSO溶解),接种L2阶段的线虫处理24小时。再在L4阶段检测目的蛋白的表达情况。
实验结果:

图1. NRX-1通过细胞内相互作用稳定突触前结构
在C. elegans中,neurexin基因(nrx-1)编码的NRX-1蛋白有两种主要亚型:α/long和γ/short。其中,γ/short亚型缺乏经典的跨突触结合域,但仍然能够通过其细胞内结构域(ICD)稳定突触前结构。实验中,即使在缺乏跨突触相互作用的情况下,表达γ/short亚型的NRX-1也能恢复突触前结构的丢失表型。这表明NRX-1的细胞内功能对于突触前结构的稳定至关重要,且不依赖于跨突触相互作用。
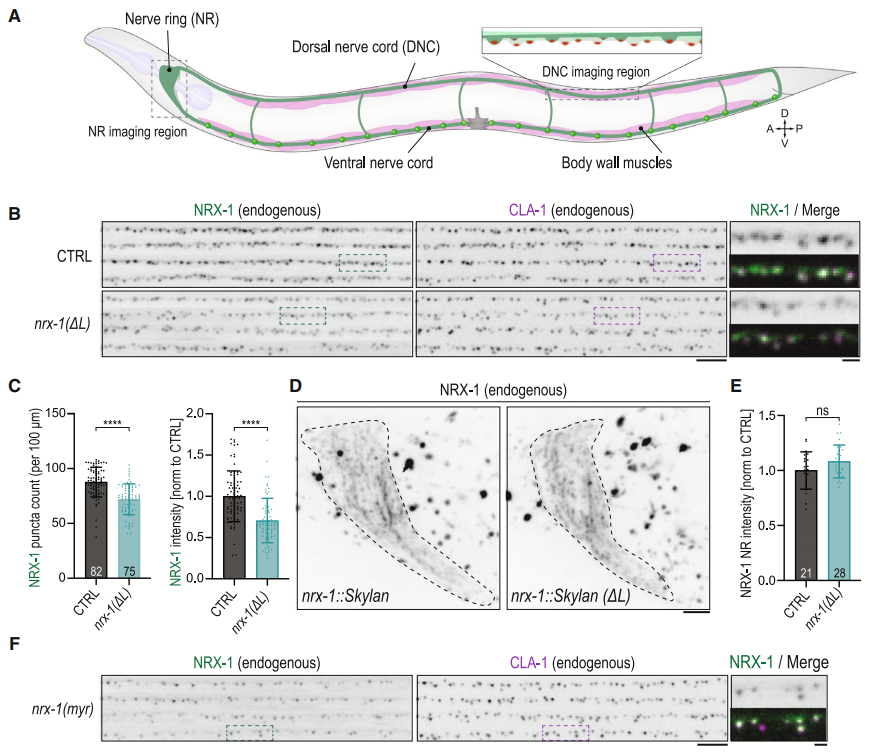
图2. NRX-1 突触定位由其 ICD 介导
进一步的研究发现,NRX-1的突触前定位并不依赖于其细胞外结构域。通过活体成像技术,研究者们观察到NRX-1在突触前结构中的聚集并不需要neuroligin(Neuroligin 是一种突触后细胞黏附分子,通过与突触前的 Neurexin 结合,促进突触的形成和稳定)。即使在缺乏neuroligin的情况下,NRX-1依然能够聚集在突触前活性区。此外,即使将NRX-1的细胞外结构域完全敲除,仅保留细胞内结构域,也能实现其突触前定位。这进一步证实了NRX-1的细胞内相互作用在突触定位中的关键作用。
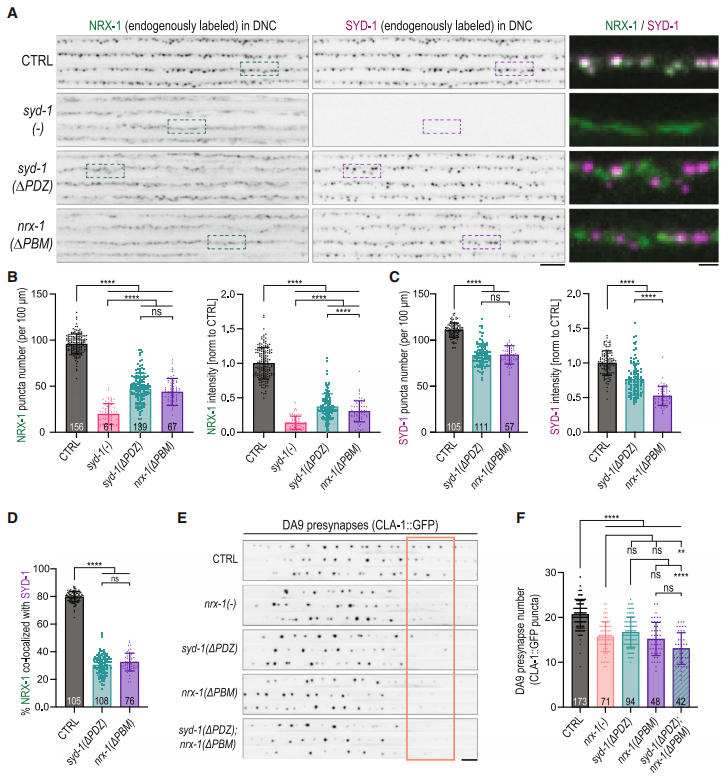
图3. SYD-1通过PDZ结构域招募NRX-1
研究者们进一步探索了NRX-1的招募机制,发现SYD-1蛋白通过其PDZ结构域与NRX-1的细胞内结构域相互作用,从而将NRX-1招募到突触前结构中。通过基因编辑技术,研究者们敲除了SYD-1的PDZ结构域或NRX-1的PDZ结合基序(PBM),结果发现NRX-1的聚集和突触前结构的稳定性显著下降。这表明SYD-1和NRX-1之间通过PDZ结构域的相互作用对于突触前结构的组装和稳定至关重要。
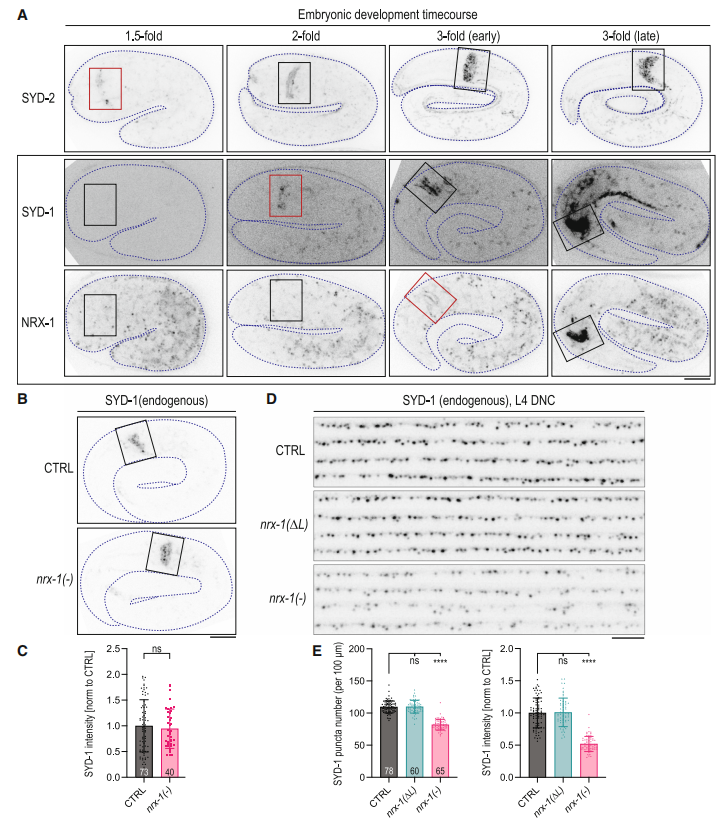
图4. SYD-1的积累先于NRX-1出现在新生的突触前结构中
通过发育阶段的成像分析,研究者们发现SYD-1在胚胎发育过程中先于NRX-1积累在突触前结构中。SYD-1的早期积累为后续NRX-1的招募提供了基础。尽管SYD-1的初始定位不依赖于NRX-1,但NRX-1的存在对于SYD-1在发育后期的稳定性至关重要。这表明SYD-1和NRX-1在突触前结构的组装中相互依赖,共同维持突触的稳定性。
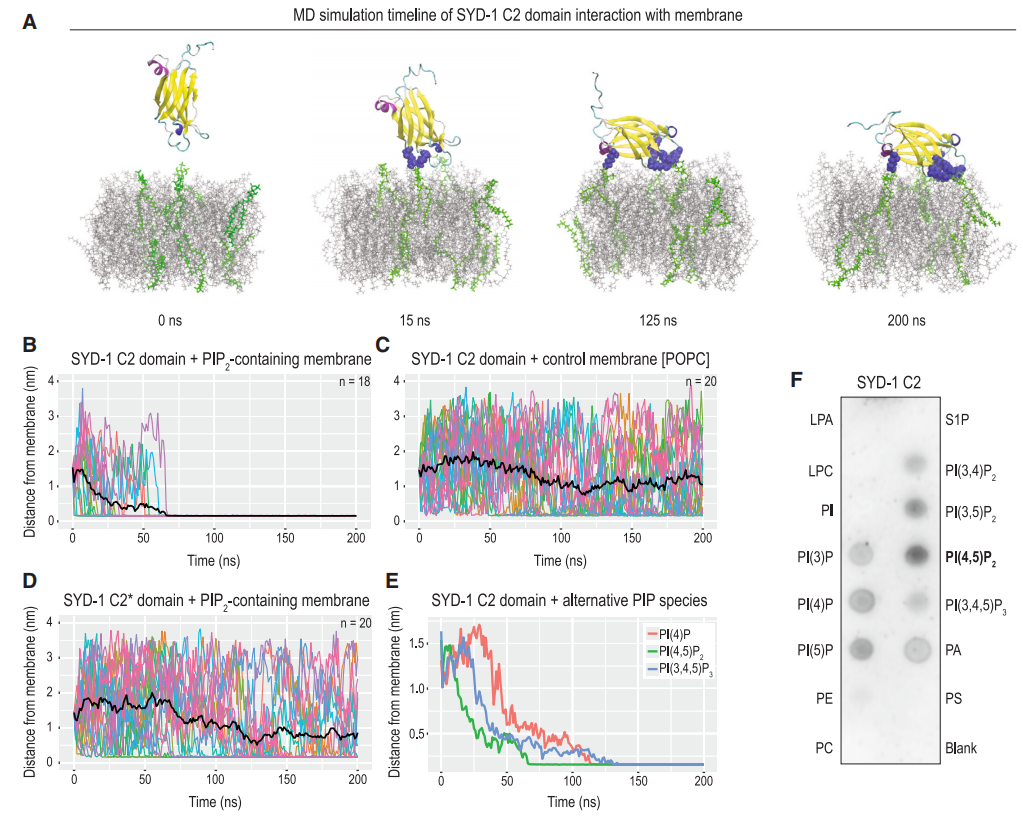
图5. SYD-1通过C2和PDZ结构域与PIP2相互作用
为了揭示SYD-1如何定位到质膜,研究者们进行了分子动力学模拟和生化实验。结果表明,SYD-1的C2和PDZ结构域能够与质膜中的PIP2(磷脂酰肌醇4,5-二磷酸)相互作用。通过模拟和实验验证,研究者们发现SYD-1的C2结构域与PIP2的结合位点,并且这种结合对于SYD-1的突触前定位至关重要。此外,通过5-Ph-IAA(来自AmBeed)诱导PPK-1蛋白的降解,研究者们进一步证实了PIP2在SYD-1定位中的作用。
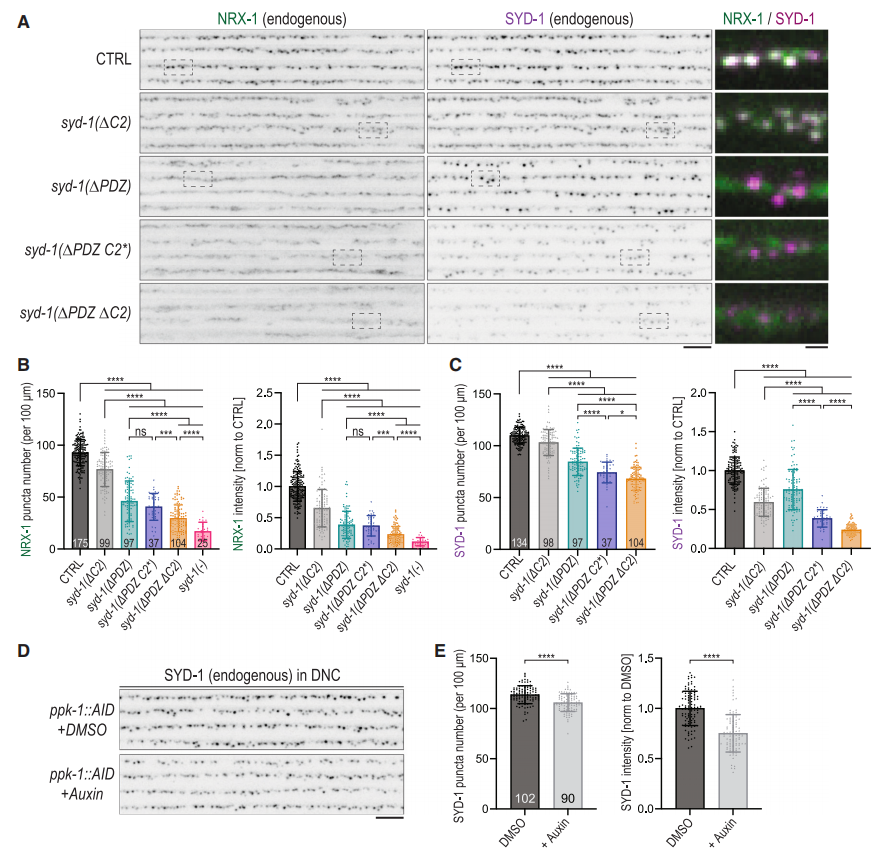
图6. SYD-1的C2和PDZ结构域在突触前定位中的作用
通过基因编辑技术,研究者们分别敲除了SYD-1的C2和PDZ结构域,并观察了这些突变对SYD-1突触前定位的影响。结果表明,单独敲除C2或PDZ结构域对SYD-1的突触前定位影响较小,但同时敲除这两个结构域会导致SYD-1在突触前结构中的显著减少。这进一步证实了SYD-1通过其C2和PDZ结构域与PIP2相互作用,从而实现其在突触前结构中的定位。
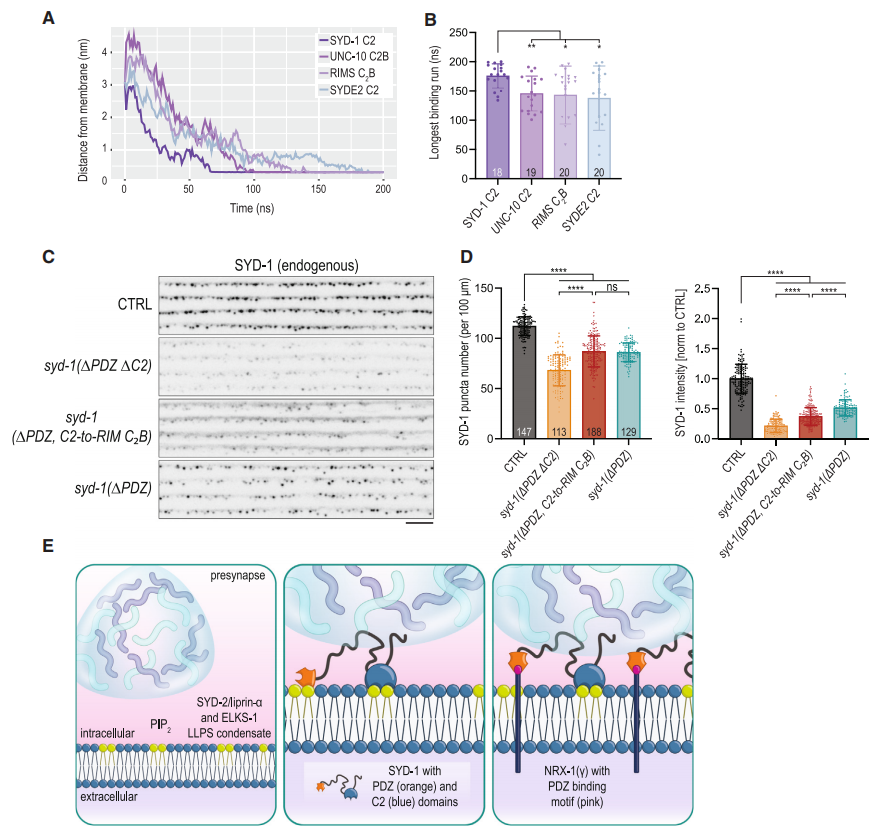
图7. RIM1的C2B结构域可部分补偿SYD-1的C2结构域的丢失
为了探索SYD-1功能的进化保守性,研究者们将哺乳动物RIM1的C2B结构域替换到SYD-1的C2结构域位置。结果发现,这种替换能够部分恢复SYD-1在突触前结构中的聚集,但无法完全恢复其强度。这表明SYD-1的C2结构域在与PIP2相互作用中具有独特的功能,同时也揭示了进化上保守的蛋白-脂质相互作用机制。
研究结论:
此研究揭示了突触前结构组装的新机制,表明细胞内蛋白-脂质相互作用在neurexin招募之前就已经开始发挥作用。研究发现,SYD-1作为突触前活性区的支架蛋白,通过其C2和PDZ结构域与质膜中的PIP2相互作用,从而在新生突触前结构中积累。随后,SYD-1通过PDZ结构域与neurexin的细胞内结构域相互作用,将neurexin招募到突触前位点。这一过程不依赖于neurexin的经典跨突触相互作用,而是通过细胞内机制实现。此外,研究还发现neurexin的γ/short亚型足以通过细胞内相互作用稳定突触前结构,而不需要跨突触结合域。这些发现不仅挑战了传统的突触形成模型,还强调了细胞内蛋白-脂质相互作用在突触发育中的重要性,并为理解神经系统发育和功能提供了新的视角。
Doi: 10.1016/j.neuron.2024.12.017











