AmBeed文献解读|Advanced Science
Pristimerin靶向HSPA8激活VAV1/ERK通路抑制TNBC恶性进展

2025年1月,南方医科大学官道刚研究团队在《Advanced Science》发表题为《Pristimerin Promotes Ubiquitination of HSPA8 and Activates the VAV1/ERK Pathway to Suppress TNBC Proliferation》的研究。本文通过多种分子生物学和细胞生物学手段,揭示了天然化合物Pristimerin通过促进热休克蛋白HSPA8的泛素化降解,并激活VAV1/ERK通路,抑制三阴性乳腺癌(TNBC)细胞增殖的分子机制。
研究背景:
三阴性乳腺癌(TNBC)是一种预后较差的乳腺癌亚型,缺乏雌激素受体、孕激素受体表达,且无HER2过表达或基因扩增。高度异质性、侵袭性强和缺乏有效治疗靶点是TNBC的三大特点。目前,化疗是TNBC的主要治疗手段,但患者常对药物产生耐药性。因此,寻找更有效的抗肿瘤药物是医学界的共同目标。天然化合物Pristimerin已被证明具有抗炎、抗菌、抗真菌和抗肿瘤等多种生物活性,但其在TNBC中的具体作用机制尚不清楚。
研究目的:
本研究旨在探讨Pristimerin在TNBC中的抗肿瘤作用及其分子机制,特别是其对HSPA8蛋白的调控及其下游信号通路的影响。
研究结论:
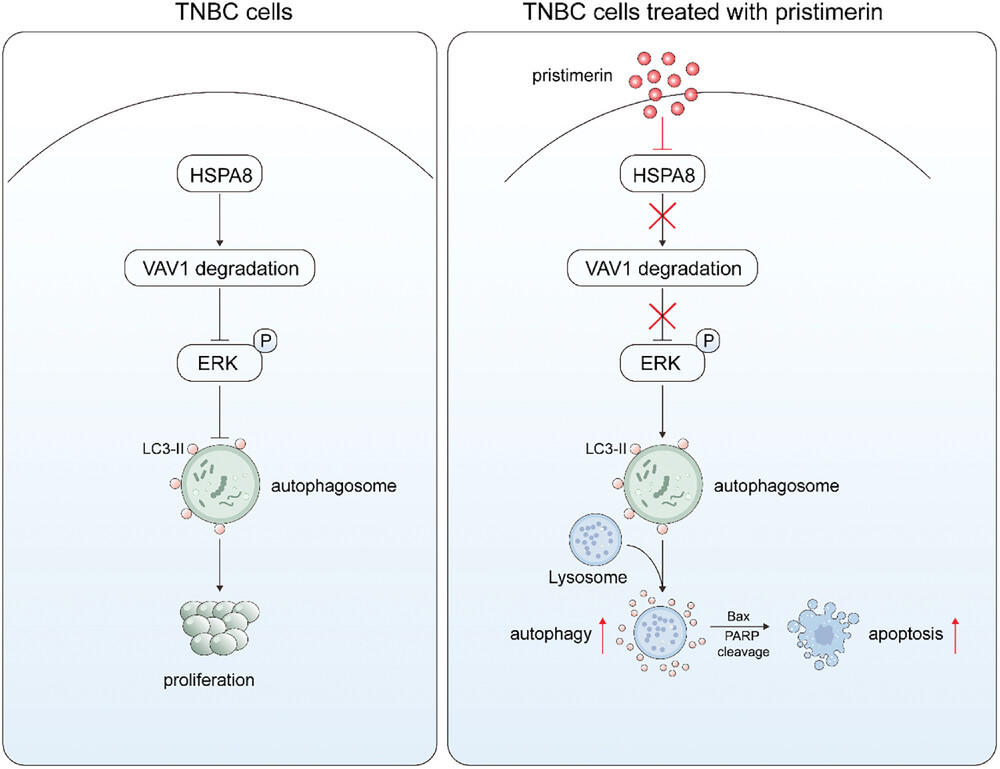
Pristimerin抑制TNBC进展的分子机制:在TNBC细胞中,HSPA8通过促进VAV1的降解,抑制ERK通路的激活,进而抑制细胞自噬,并调节细胞增殖与凋亡之间的平衡。然而,在Pristimerin存在时,Pristimerin直接靶向HSPA8,促进其泛素化和蛋白酶体降解。这一过程进一步抑制了HSPA8下游客户蛋白VAV1的降解,导致ERK通路的激活,并介导细胞自噬和凋亡。最终,这些变化抑制了细胞增殖、细胞迁移,并克服了药物耐受性。
产品:
Ferrostatin-1,Z-VAD-FMK,tetrathiomolybdate等抑制剂产品来自AmBeed品牌

产品1:Ferrostatin-1(A228648)
作用机制:Ferrostatin-1是一种铁死亡(ferroptosis)抑制剂,通过抑制脂质过氧化和铁依赖性细胞死亡来保护细胞。
在本文中的应用:用于评估Pristimerin是否通过诱导铁死亡来抑制TNBC细胞增殖。实验结果显示,Ferrostatin-1对Pristimerin诱导的TNBC细胞死亡没有显著影响,表明Pristimerin的作用可能不涉及铁死亡机制。
产品2:Z-VAD-FMK(A834991)
作用机制:Z-VAD-FMK是一种泛半胱天冬酶(caspase)抑制剂,广泛用于抑制细胞凋亡。它通过抑制caspase家族蛋白的活性来阻止细胞凋亡的执行。
在本文中的应用:用于评估Pristimerin是否通过诱导凋亡来抑制TNBC细胞增殖。实验结果显示,Z-VAD-FMK部分逆转了Pristimerin诱导的TNBC细胞死亡,表明Pristimerin的作用部分依赖于凋亡机制。
产品3:Tetrathiomolybdate(A1897106)
作用机制:Tetrathiomolybdate是一种铜螯合剂,用于抑制铜依赖性细胞死亡。它通过螯合细胞内的铜离子,减少铜诱导的氧化应激和细胞死亡。
在本文中的应用:用于评估Pristimerin是否通过诱导铜依赖性细胞死亡来抑制TNBC细胞增殖。实验结果显示,Tetrathiomolybdate对Pristimerin诱导的TNBC细胞死亡没有显著影响,表明Pristimerin的作用可能不涉及铜依赖性细胞死亡机制。
主要研究结果:
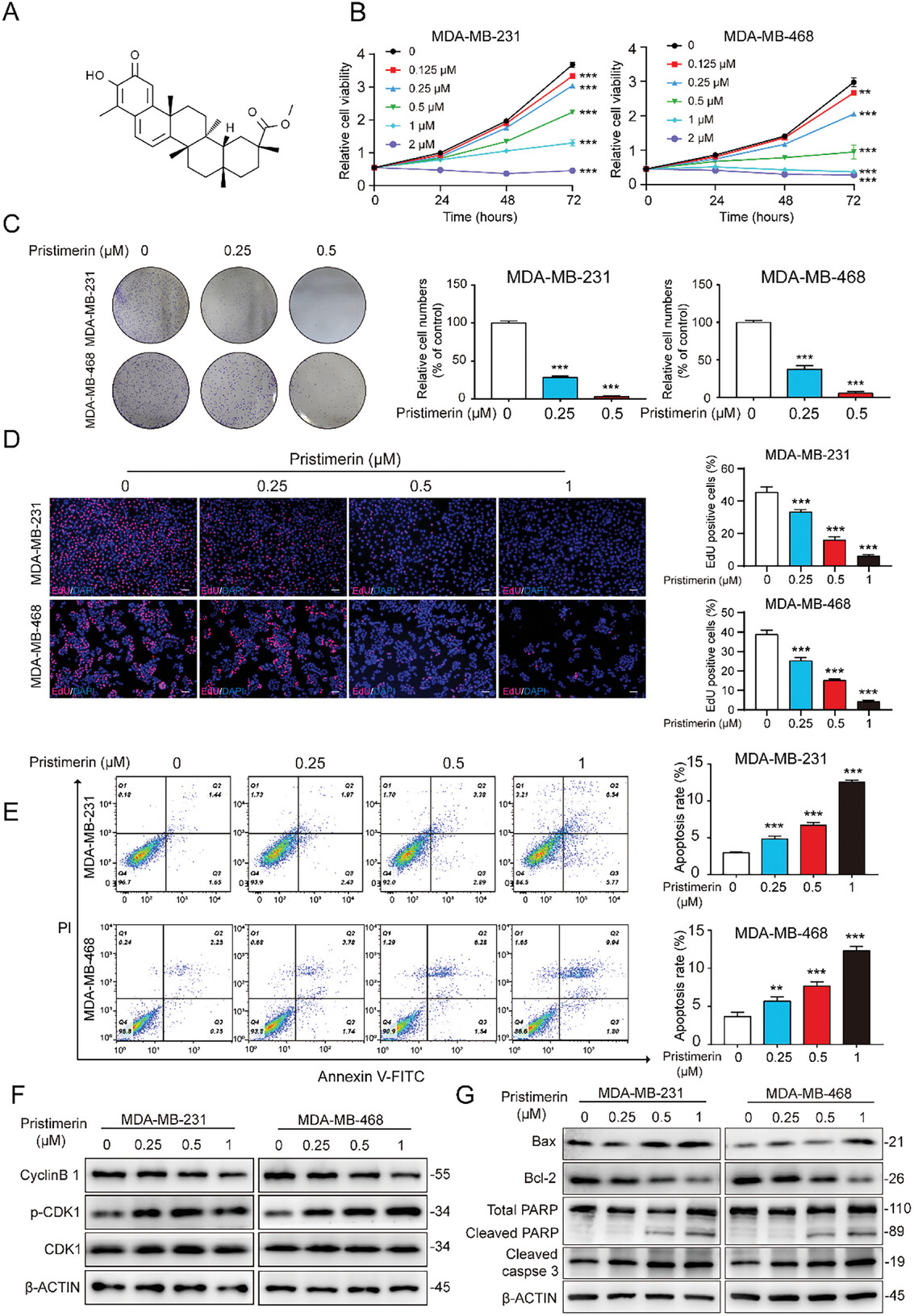
图1. Pristimerin抑制TNBC细胞增殖并诱导凋亡
通过CCK-8实验、克隆形成实验、EdU染色和流式细胞术评估Pristimerin对TNBC细胞增殖和凋亡的影响,研究人员发现Pristimerin以时间和浓度依赖性方式显著抑制TNBC细胞的增殖。Pristimerin处理后,TNBC细胞的克隆形成能力显著下降,细胞周期停滞在G2/M期。Pristimerin显著增加TNBC细胞的凋亡率,上调促凋亡蛋白Bax、cleaved PARP和cleaved caspase-3的表达,同时下调抗凋亡蛋白Bcl-2的表达。
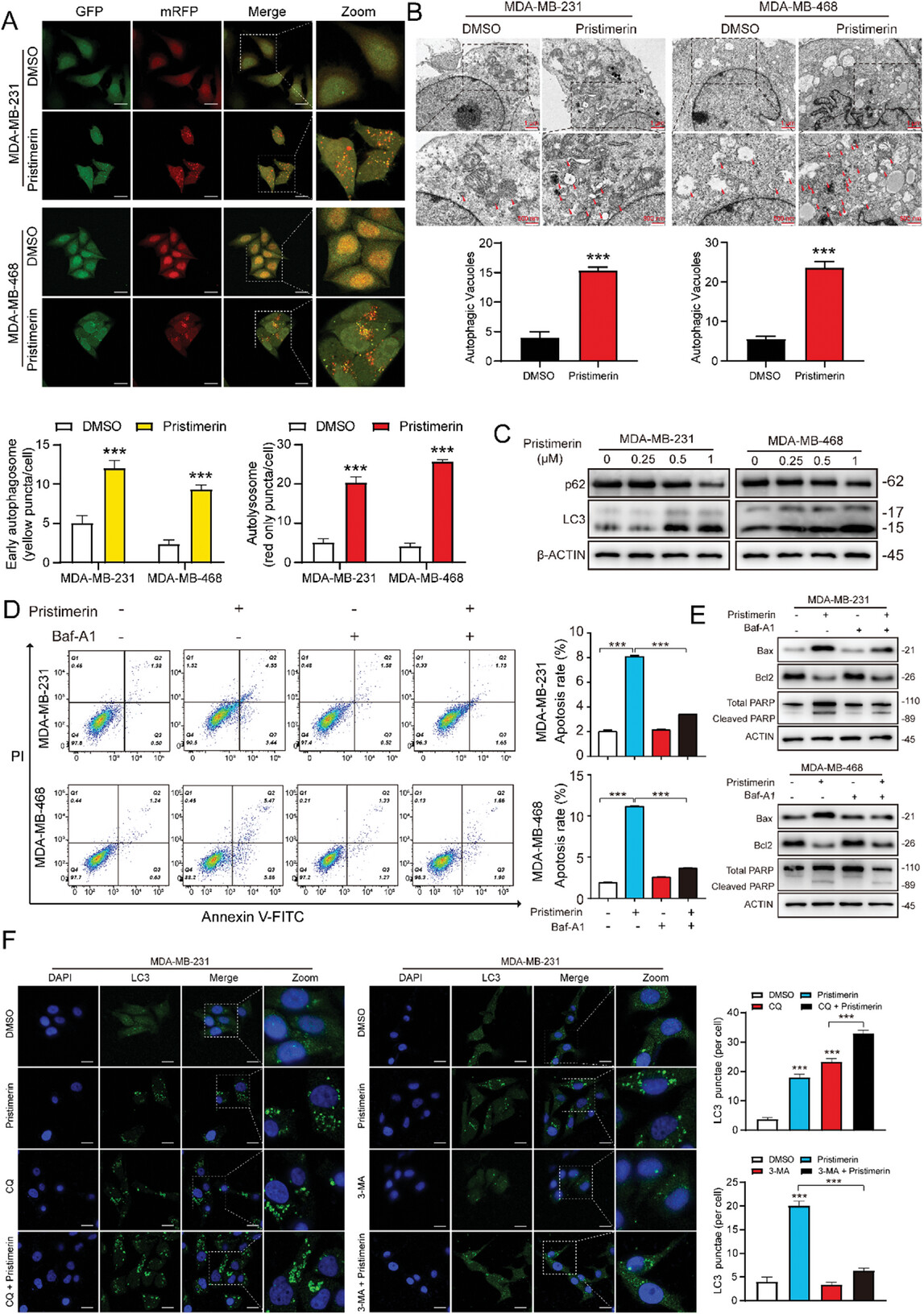
图2. Pristimerin通过激活自噬在TNBC中发挥抗肿瘤作用
研究人员采用 GFP-RFP-LC3 慢病毒感染 MDA-MB-231 和 MDA-MB-468 细胞,观察早期自噬体和晚期自噬溶酶体,研究结果显示Pristimerin处理后,TNBC细胞中自噬体和自噬溶酶体的数量显著增加。且Pristimerin促进LC3-I向LC3-II的转化,同时降低p62蛋白的表达。为了进一步验证自噬在诱导细胞凋亡中的作用,使用自噬抑制剂 Baf-A1 进行了拯救实验,研究结果表明Baf-A1部分逆转了Pristimerin对TNBC细胞增殖和凋亡的影响,这说明Pristimerin通过激活自噬发挥抗肿瘤作用。
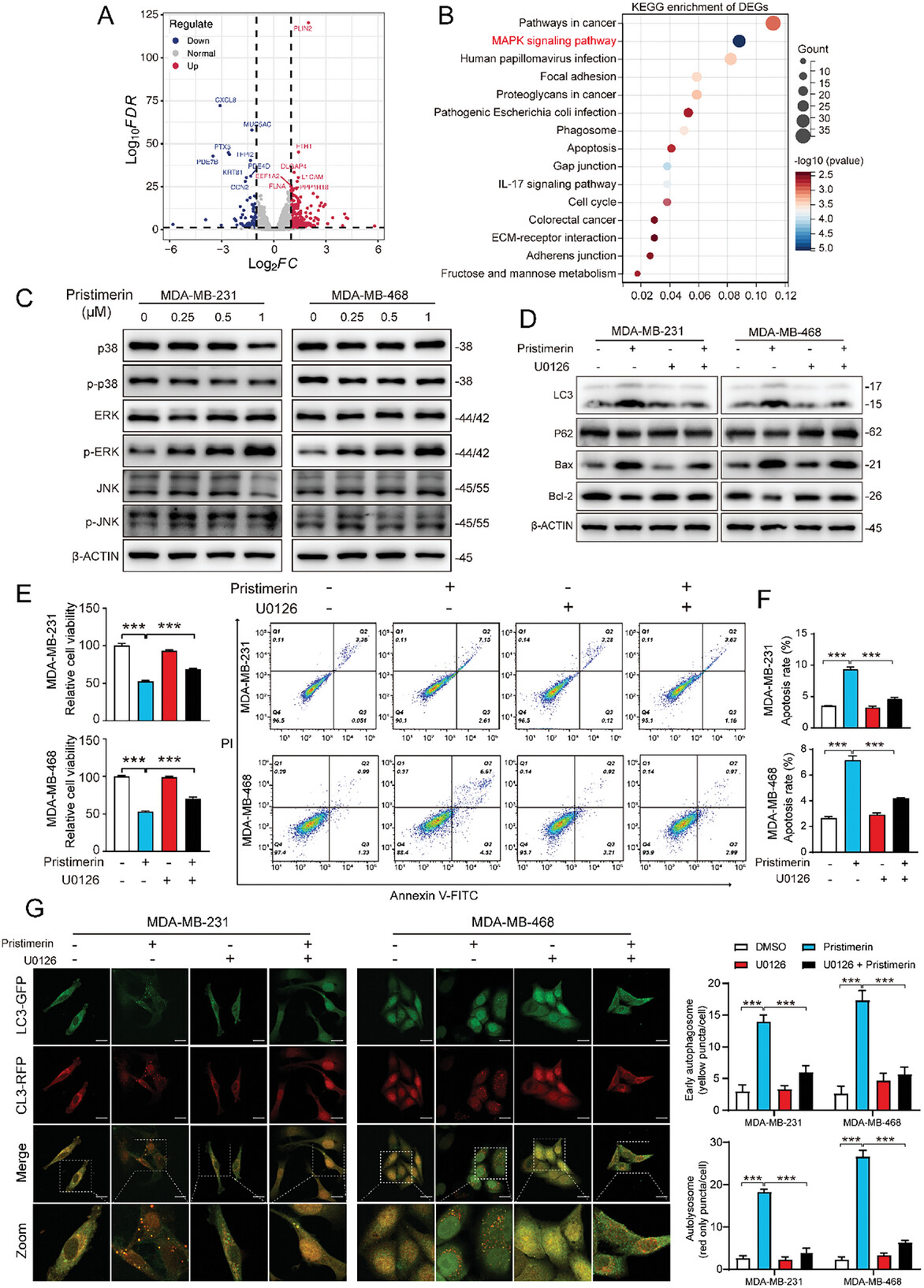
图3. Pristimerin通过MAPK/ERK通路激活自噬
为了阐明 Pristimerin诱导细胞自噬的潜在机制,研究人员通过 RNA 测序 (RNA-seq) 比较了 MDA-MB-231 细胞使用 Pristimerin或 DMSO 处理 48 小时的转录表达谱。RNA-seq分析显示Pristimerin处理后,与细胞死亡相关的多个生物学过程(包括自噬、细胞周期停滞、DNA损伤和凋亡)发生显著变化。Pristimerin显著激活MAPK/ERK通路,而不影响JNK和p38 MAPK通路。
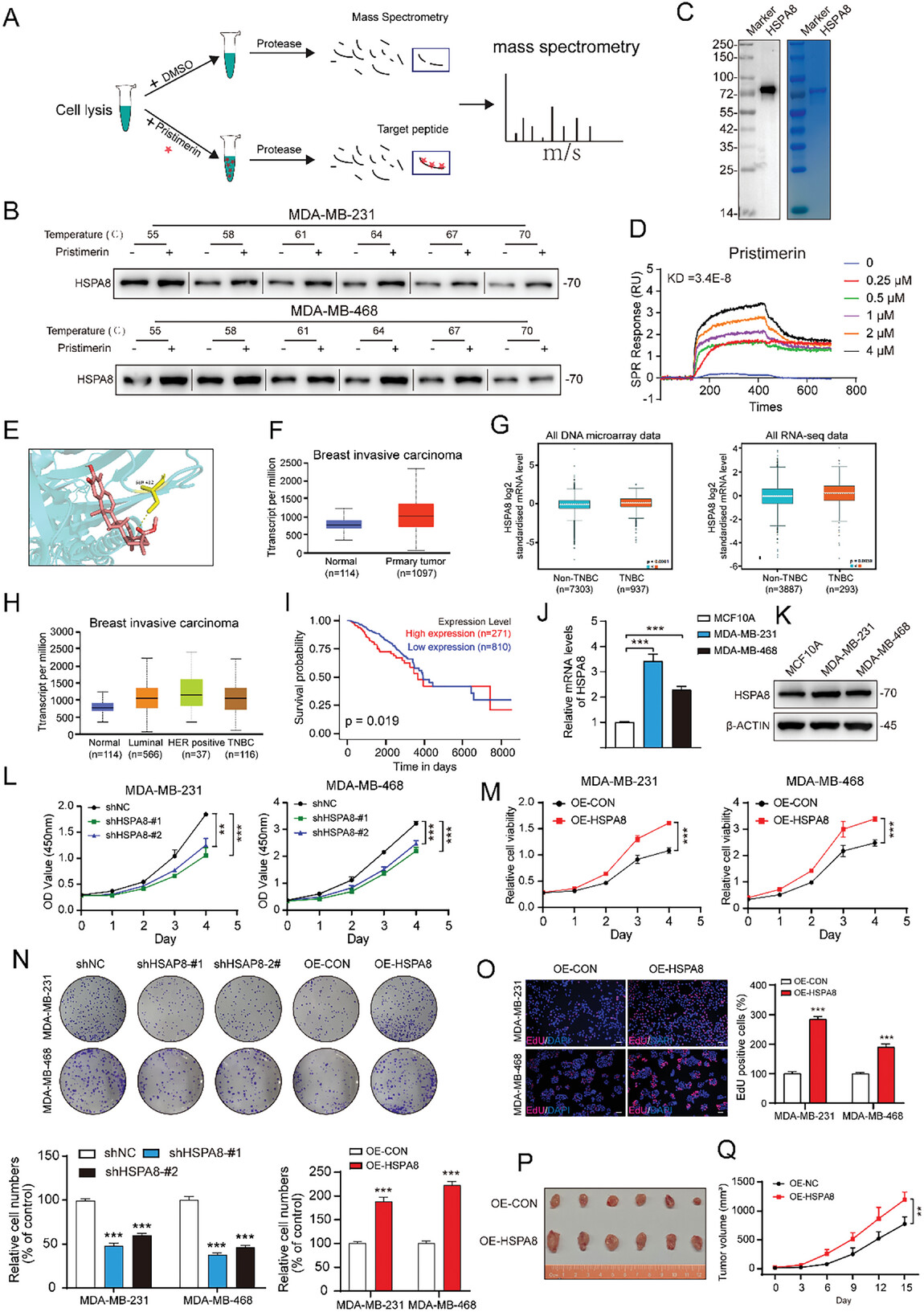
图4. HSPA8有助于TNBC细胞的生长,而Pristimerin直接靶向HSPA8 蛋白
研究人员通过DARTS-MS技术鉴定出Pristimerin的直接结合靶点为HSPA8,同时利用CETSA和SPR实验验证了Pristimerin与HSPA8的结合,通过分子对接模拟了 HSPA8 与 Pristimerin的结合。
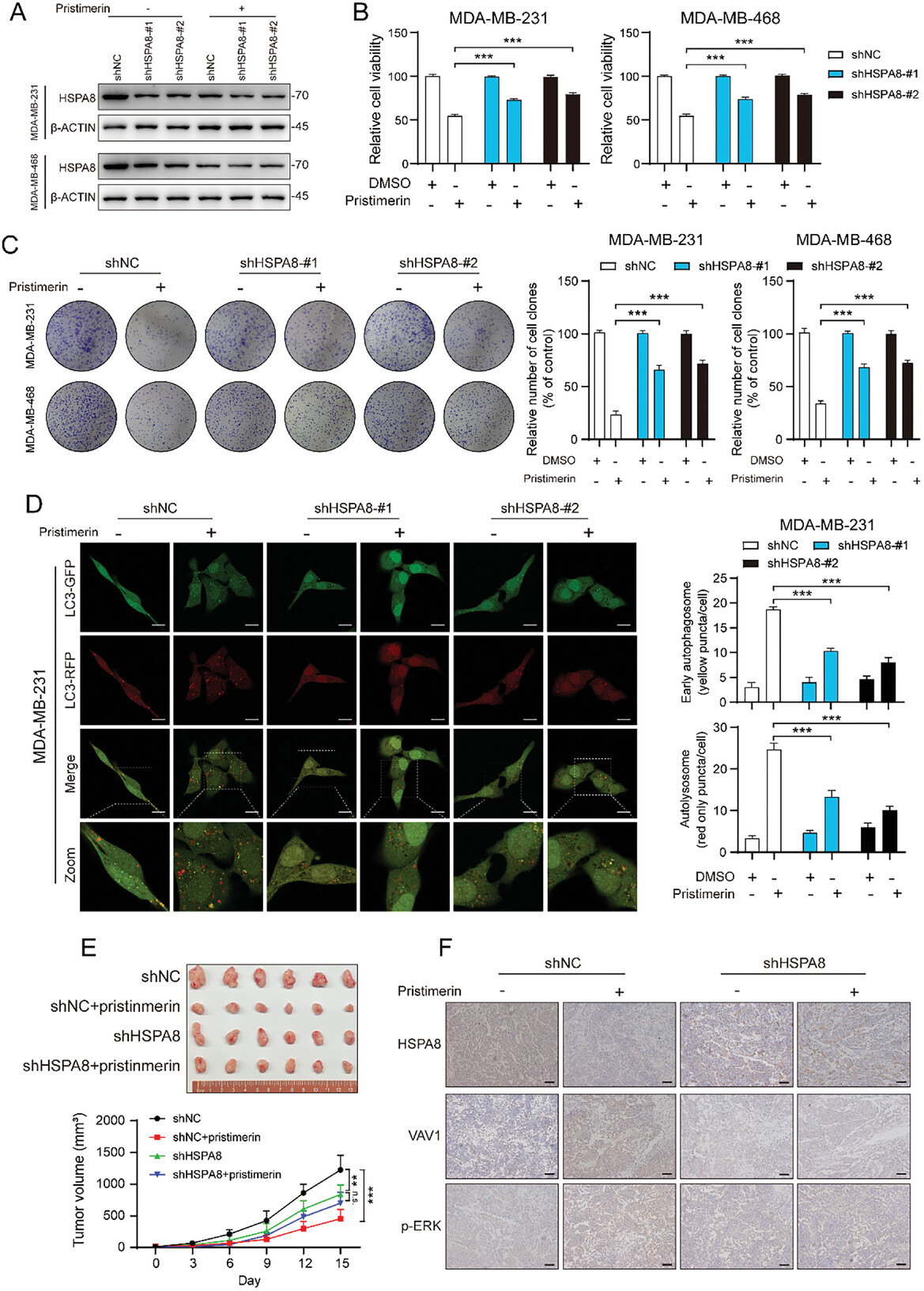
图5. Pristimerin的抗癌活性依赖于HSPA8
HSPA8的敲低实验表明,HSPA8 敲低部分减轻了 Pristimerin对细胞生长的抑制作用,同时Pristimerin诱导的早期自噬体和晚期自噬溶酶体水平升高也显着降低。更重要的是,体内实验表明,当 HSPA8 表达下调时,TNBC 肿瘤异种移植物对 Pristimerin的敏感性较低。这些实验都表明HSPA8在Pristimerin的抗肿瘤活性中起关键作用。
图6. Pristimerin减弱HSPA8介导的VAV1降解
研究结果表明,Pristimerin以剂量依赖性方式降低HSPA8的蛋白表达。具体而言,Pristimerin促进了泛素分子与 HSPA8 的结合,从而显着增强了 HSPA8 的泛素化降解而其转录水平不受影响。同时,研究人员验证了 HSPA8 和 VAV1 之间的表达关系,研究结果表明 HSPA8 和 VAV1 表达水平之间存在负相关,这与 HSPA8 介导 VAV1 降解的结论一致。而Pristimerin则以浓度依赖性方式抑制VAV1蛋白的降解。总的来说,Pristimerin促进HSPA8的泛素化降解,抑制HSPA8介导的VAV1降解,激活 VAV1/ERK 信号通路,导致细胞自噬和细胞凋亡。
图7. Pristimerin抑制TNBC细胞迁移和侵袭
Pristimerin显著抑制TNBC细胞的迁移和侵袭能力,增加上皮细胞标记物ZO-1和β-catenin的表达,降低间充质细胞标记物Vimentin和Slug的表达。此外,Pristimerin与低剂量多柔比星联合使用时,显著抑制TNBC细胞的增殖、迁移和侵袭,表明Pristimerin可能增强TNBC细胞对多柔比星的敏感性。
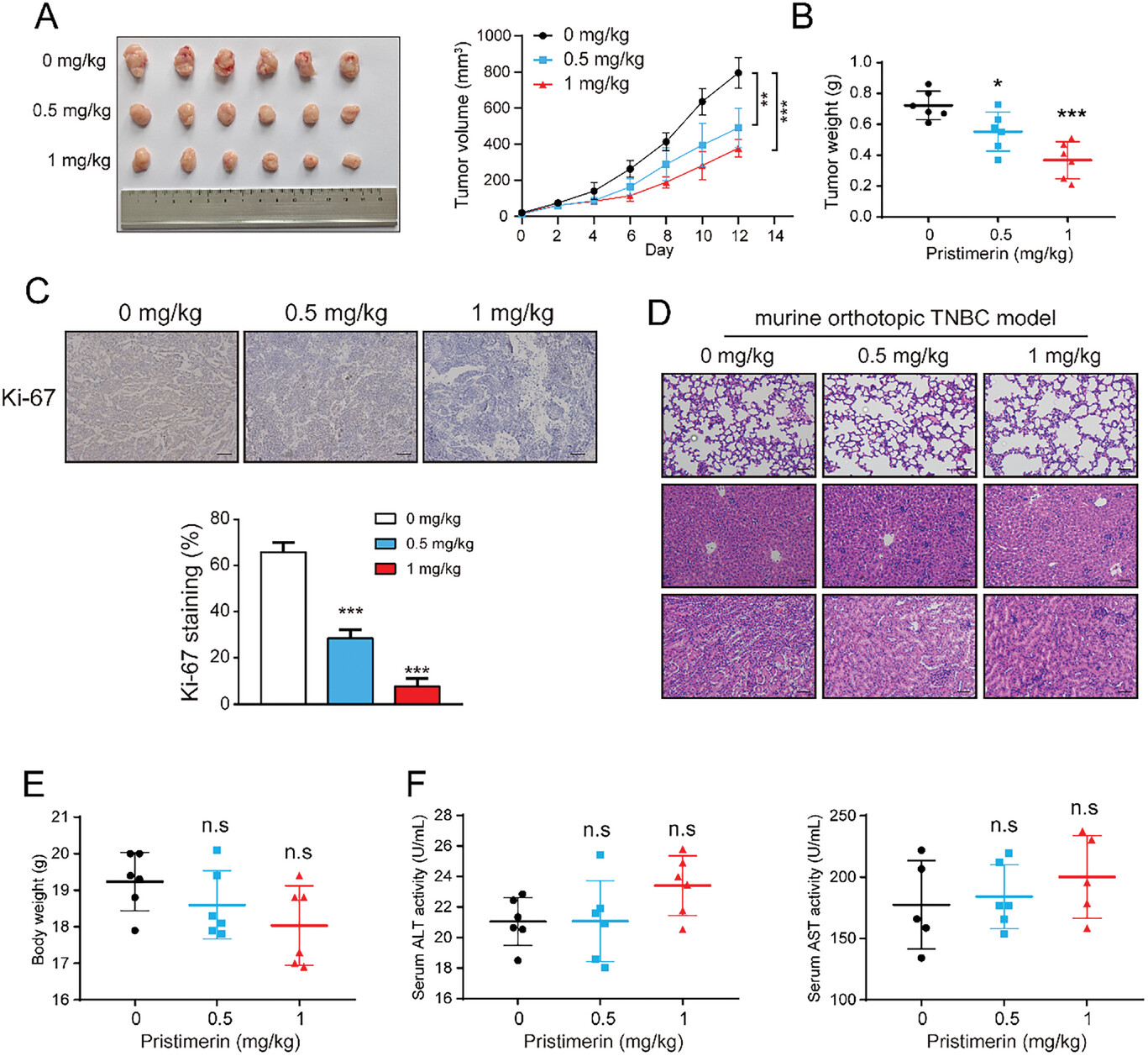
图8. Pristimerin在体内抑制TNBC生长
在小鼠原位TNBC模型和皮下异种移植肿瘤模型中,Pristimerin显著抑制TNBC的生长,降低肿瘤体积和重量。同时,免疫组化和Western blot分析显示Pristimerin促进ERK的磷酸化,激活细胞自噬和凋亡。
结论:
本研究揭示了Pristimerin通过直接靶向HSPA8,促进其泛素化降解,抑制HSPA8介导的VAV1降解,激活ERK通路,从而促进TNBC细胞的自噬和凋亡。Pristimerin不仅抑制TNBC细胞的增殖、迁移和侵袭,还增强TNBC细胞对多柔比星的敏感性。动物实验结果表明Pristimerin具有良好的治疗效果和安全性,为TNBC的治疗提供了新的潜在药物候选物。
Doi: 10.1002/advs.202413174