
AmBeed文献解读|Nature Communications
一种原位长效缓释的TLR7/8激动剂与TGFβ抑制剂联用可促进抗肿瘤免疫反应

2024年9月3日,丹麦技术大学Thomas L. Andresen课题组在Nature Communications上发表题为《一种原位长效缓释的TLR7/8激动剂与TGFβ抑制剂联用可促进抗肿瘤免疫反应》的研究。
摘要
异种实体癌治疗过程中的免疫应答需要在肿瘤微环境(TME)中抗原亲和但免疫抑制的情况下协同激活。然而,可塑性TME和免疫激活药物的系统耐受性差是产生抗癌免疫反应的根本障碍。由此,作者引入CarboCell技术,通过在肿瘤内形成一个持续的药物释放库来克服这些障碍,选择性地在TME内提供有效载荷高的免疫药物。CarboCell诱导免疫细胞极化,并进一步驱动和维持肿瘤引流淋巴结处于抗癌和免疫激活状态。从机理上讲,这转化了癌组织,从而产生全身抗癌免疫反应。CarboCell可通过标准细针技术注射,并成像对比,确保精确的肿瘤内定位。作者发现了一种双药CarboCell在雌性小鼠的临床前肿瘤模型中Toll样受体7/8(TLR7/8)激动剂和转化生长因子-β(TGF-β)抑制剂的持续释放的治疗效果。
亮点
1. 作者引入了CarboCell平台,该技术可以提供肿瘤内持续的高浓度药物剂量,同时将脱靶效应降至最低,并可通过修改 CarboCell 组分来控制药物释放给药间隔。
2. 持续的肿瘤内药物活性刺激肿瘤定向免疫激活,证实了 TLR7/8 激活和 TGFβ 抑制的协同作用。
研究背景
抗癌免疫反应在富含抗原的癌组织和相关淋巴结中产生。然而,在大多数癌症患者中,抗癌免疫反应被免疫抑制性肿瘤微环境(TME)所阻碍,导致适应性免疫反应的组织不良和不协调。免疫抑制TME是一个靶点,如果成功转化,可以改善癌症治疗的结果。免疫激活化合物能激活和连接先天和后天免疫,是实现这一转变的最有希望的候选者之一。然而,这些药物的全身给药具有挑战性,并且具有剂量限制性毒性风险。这些药物的直接肿瘤内给药提供了一种耐受且治疗有效的替代方案,可进一步产生全身抗癌免疫反应。
研究内容
CarboCell提供持续的肿瘤药物活性和最小的全身接触
CarboCell是一种液体组合物,包括碳水化合物酯、甘油三酯、聚合物添加剂和乙醇作为溶剂的混合物(图1b)。CarboCell本质上是疏水性的,可用于递送多种亲脂性药物(logP > 0)。TLR7/8a Resiquimod (R848, logP = 1.7, 图1b)和TGFβi RepSox (logP = 2.5,图1b)在CarboCell中共同配制,因为两种化合物都是亲脂性的,具有相当的logP,使得这些药物对于同步双重释放是最佳的。
肿瘤内技术本质上依赖于支持精确和安全放置的能力。CarboCell的成像特性有助于注射和验证储库的形成。实验发现CarboCell在肿瘤内能形成稳定沉积物的能力。随后作者研究了R848的体内药代动力学和生物分布(PK/BD),验证了CarboCell提供的持续肿瘤内药物的活性。
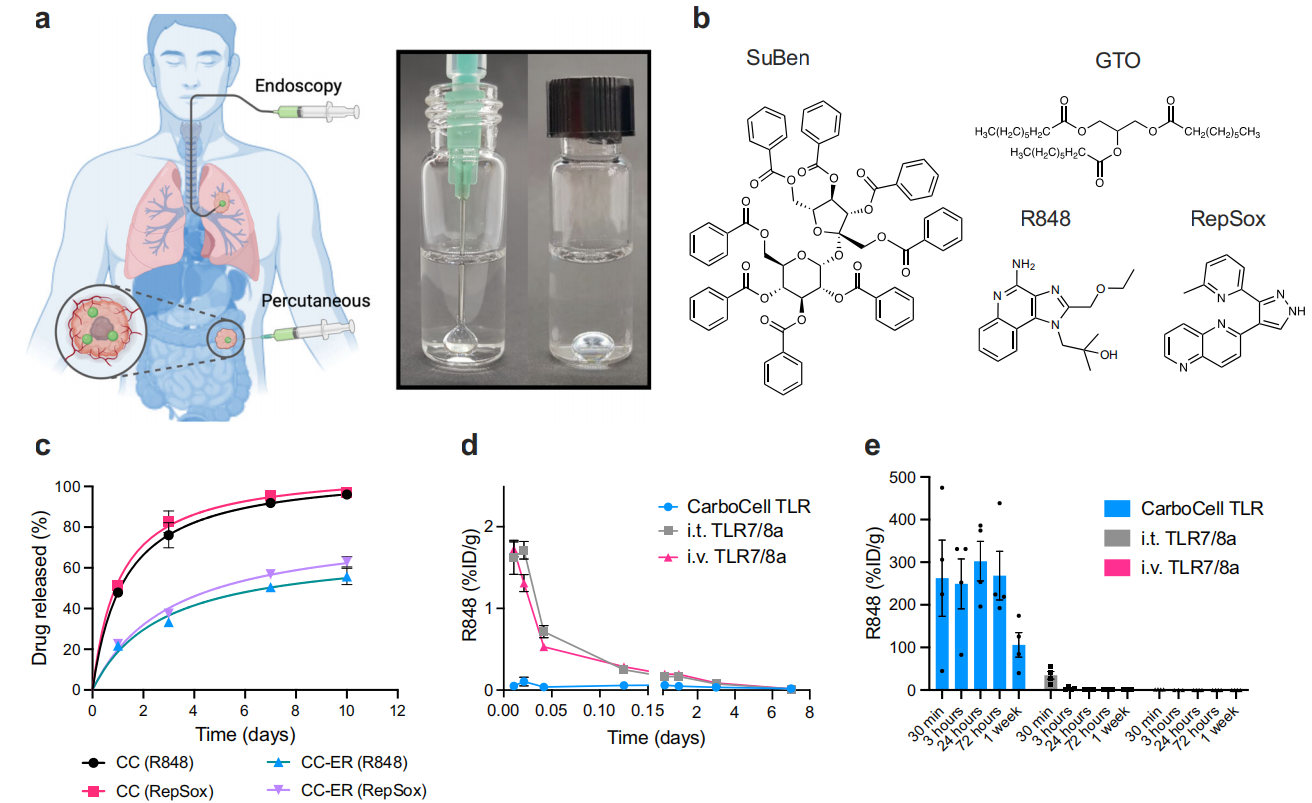
图 1 CarboCell的给药方式灵活,使得药物在肿瘤内持续释放,具有高滞留性和最少的全身溢出
CarboCell TLR: TGFb证明了联合免疫疗法的治疗优势
作者使用了一种能够持续释放TLR7/8a R848的CarboCell组合物或TLR7/8a R848和TGFβi RepSox的组合物(称为CarboCell TLR:TGFb),并在CT26肿瘤模型中进行比较,初步证明CarboCell的治疗效果,发现CarboCell TLR: TGFb治疗组显示出强大的抗癌活性。深入其机制研究,发现CarboCell TLR:TGFb能诱导癌组织坏死,炎症趋化因子Ccl4,Cxcl10和IFN-β水平显著升高,在第7天逐渐减弱(图2e和2f)。为了研究CD8 + T细胞在CarboCell TLR:TGFb治疗中的治疗意义,在两种小鼠品系中都建立了CT26肿瘤,然后在肿瘤内两次给予CarboCell TLR:TGFb(图2i)。免疫活性的BALB/c小鼠在研究期间表现出持续的肿瘤抑制(图2j)。这些发现强调了T细胞在介导CarboCell TLR:TGFb肿瘤内治疗的抗肿瘤疗效中的关键作用。
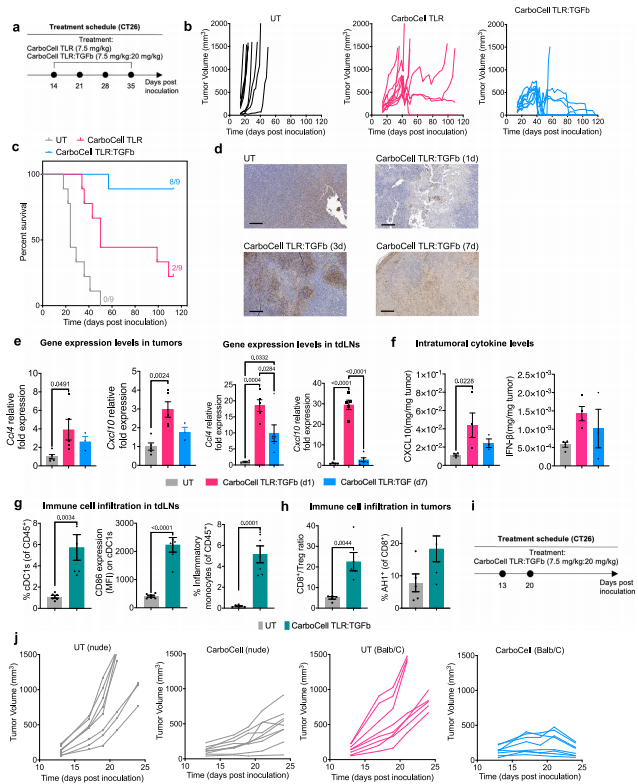
图 2 结合的CarboCell TLR:TGFb提高治疗效果,并连接先天和适应性免疫反应。
CarboCell TLR:TGFb显示了跨模型的治疗效果和免疫激活
进一步探索CarboCell在不同免疫浸润TME背景下的表现,作者比较了每周4次瘤内注射空CarboCell或CarboCell TLR:TGFb与两次瘤内注射(间隔14天)提供延长释放的CarboCell TLR:TGFb组合物的治疗效果(图3a)。CarboCell的两种组合物TLR:TGFb都能有效地降低肿瘤生长,提高动物存活率(图3b, c),而不依赖于它们不同的药物释放率。为了解释治疗效果的机制,在MC38荷瘤小鼠中进行了基因表达分析,发现在CarboCell TLR:TGFb治疗7天后,MC38肿瘤中CD8+细胞的浸润增加反映了炎症趋化因子和细胞因子水平的升高. (图3d,3e,3f)。
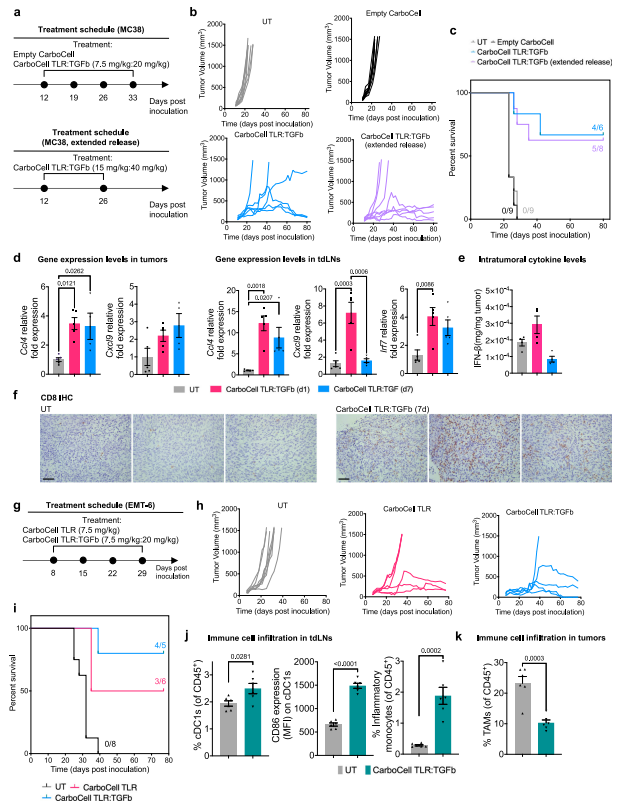
图 3 结合的CarboCell TLR:TGFb在MC38和EMT-6荷瘤小鼠中提供单药治疗活性
CarboCell诱导全身抗癌活性
为了研究CarboCell TLR:TGFb的全身抗癌特性,使用携带两个已建立的CT26肿瘤的小鼠(两侧各一个),并仅在一个肿瘤中注射CarboCell TLR:TGFb(图4a)。这产生了有效的全身抗癌反应,因为治疗降低了注射和未注射肿瘤的肿瘤生长,并导致60%的完全应答(图4b, c),从而发现了该疗法的效力。CD36表达的下降在注射和未注射肿瘤中同样明显,进一步表明CarboCell TLR:TGFb能够产生全身反应 (图4d)。通过小鼠荷瘤实验发现,CarboCell TLR:TGFb转移到荷瘤受体中时,能够产生持续的中枢免疫抗癌记忆反应,从而消除已建立的肿瘤。
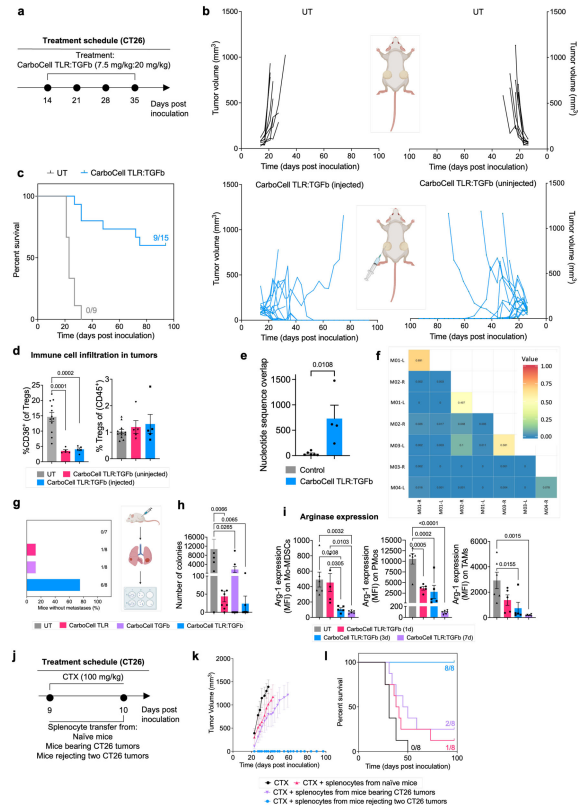
图 4 肿瘤内 CarboCell TLR:TGFb 诱导全身抗癌免疫活性和免疫记忆
CarboCell改善检查点抑制的治疗性能
由CarboCell TLR:TGFb诱导的先天和适应性免疫激活对提高免疫检查点抑制剂(ICIs)的治疗活性具有很高的吸引力。因此,作者研究了CarboCell治疗对ICI外渗的影响及其对肿瘤血管系统的影响。通过光学组织清除,共聚焦显微镜对大体积肿瘤进行3D成像,最终发现,CarboCell TLR和CarboCell TLR:TGFb刺激活肿瘤组织体积的急剧减少(图5a-c),aPD-L1对剩余活组织的靶向性增加(图5d),并且其在活组织外的分布更广泛(图5d)。作者假设CarboCell可以增强对ICIs的治疗反应。通过MC38肿瘤模型,一次肿瘤内注射缓释CarboCell TLR:TGFb与全身给药aPD-L1联合使用(图5g)。最终发现单次注射CarboCell TLR:TGFb联合aPD-L1确实导致50%的患者完全缓解,而CarboCell TLR:TGFb单药治疗的完全缓解率为25%(图5h, i)。
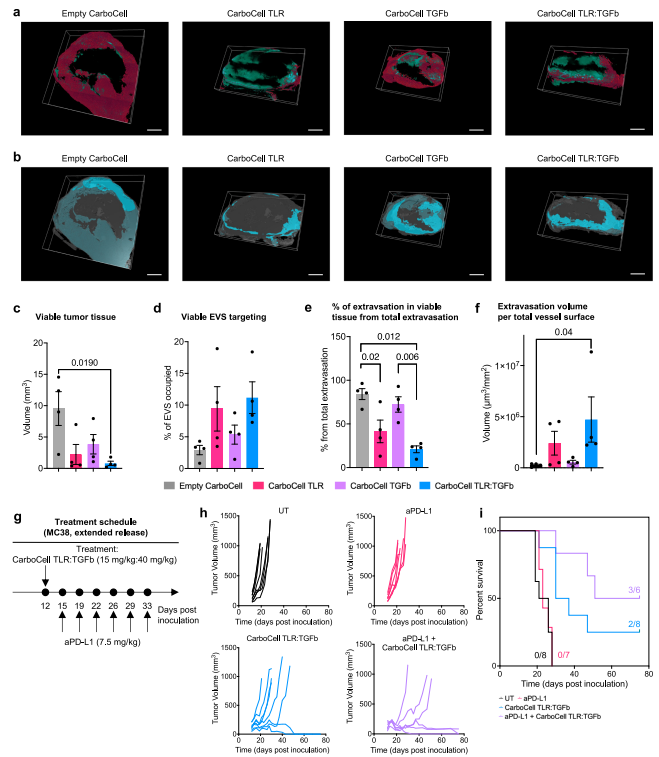
图 5 肿瘤内 CarboCell TLR:TGFb 可减少肿瘤组织体积并增强aPD-L1 免疫疗法
产品
TLR7/8a Resiquimod, R848来自AmBeed品牌
(Toll样受体7和8(TLR7/TLR8)的激动剂, A119633)
图 6 引用产品图
Doi:10.1038/s41467-024-50967-w









