AmBeed文献解读|JMC
抑制引起脑膜脑炎的福氏纳格里阿米巴原虫的饱和1,6 -萘啶并喹唑啉酮类化合物药效团的建立与优化

2024 年 10 月 15 日,威斯康星大学麦迪逊分校的Jennifer E. Golden课题组在JMC(IF=6.8)上发表题为《Pharmacophore Establishment and Optimization of Saturated 1,6-Naphthyridine-Fused Quinazolinones that Inhibit Meningoencephalitis-Causing Naegleria fowleri》的研究。研究团队开发了一种1,6 -萘啶并喹唑啉酮类化合物,这类化合物通过抑制引起脑膜炎的福氏纳格里阿米巴原虫(Naegleria fowleri)来治疗原发性阿米巴脑膜脑炎(Primary amoebic meningoencephalitis, PAM)。
研究背景
PAM是一种由Naegleria fowleri引起的罕见但高度致命的脑部感染疾病。疾病通过污染的淡水进入鼻腔而传播给人类,症状与细菌或病毒性脑膜脑炎相似,往往导致延误诊断和治疗。传统的治疗方案主要依赖于早期诊断和使用再利用的鸡尾酒药物进行治疗干预,但这些方案的效果大多是轶事性的,缺乏统计学意义。因此,研究者们迫切需要开发能够穿透大脑、无毒且有效的药物来提高患者生存率。
研究内容
在这项研究中,作者通过基于喹唑啉酮的类Mannich反应与双重排方法相结合,得到了一种喹唑啉酮-脒的顺序重排方法(SQuAReS, B→D, 图1),合成了一系列喹唑啉酮类化合物。
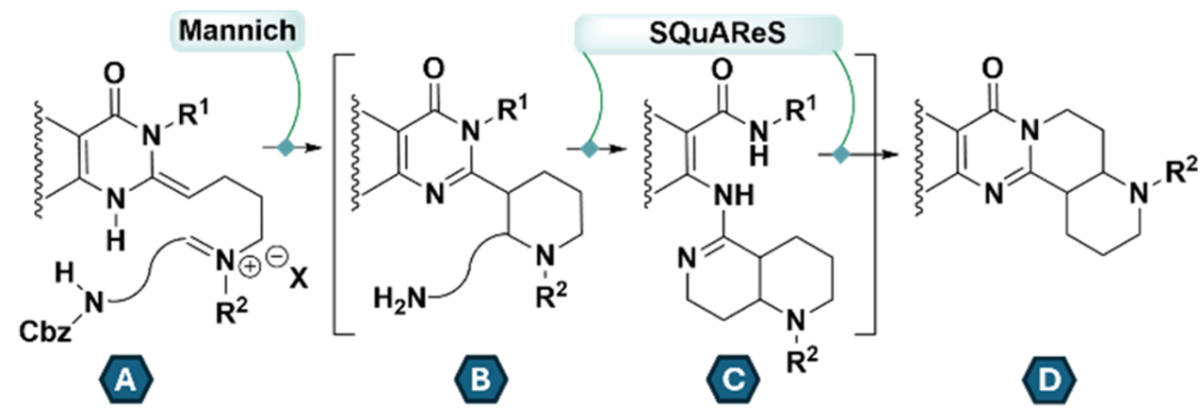
图 1. Mannich -偶合的喹唑啉酮-脒顺序重排方法
作者首先通过Mannich反应和N-脱甲基化/官能团化反应合成了53个额外的类似物(图2, 3)
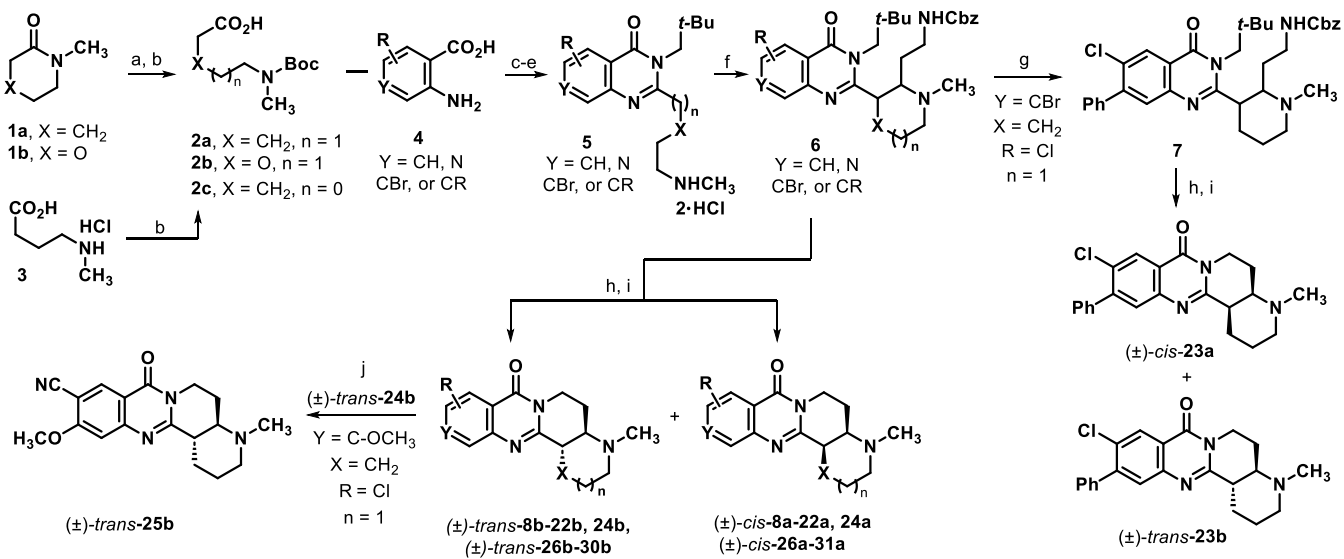
图 2. N-甲基喹唑啉酮类似物的合成
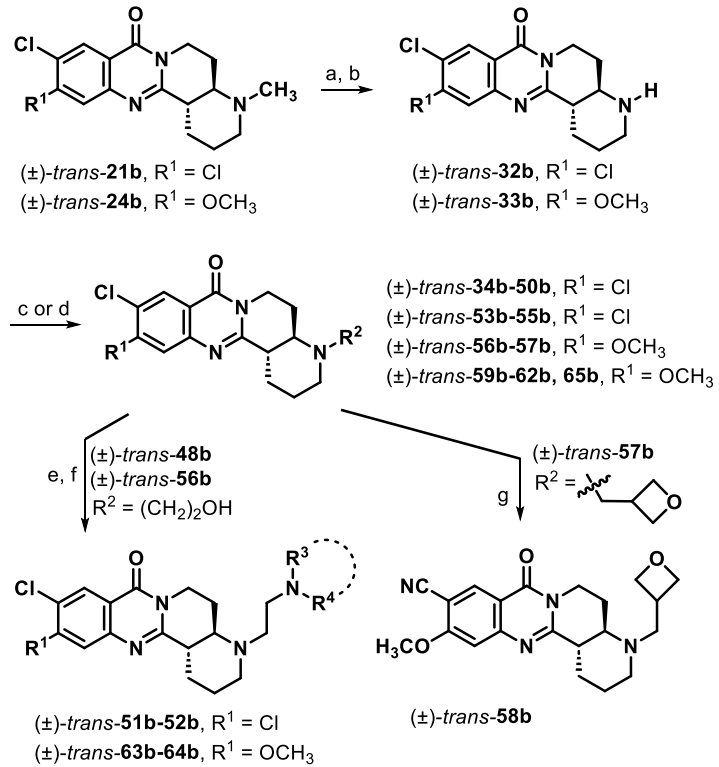
图 3. N-脱甲基化/烷基化合成路线
接着作者探索了各种苯环取代基化合物在不同浓度下对福氏纳格里阿米巴原虫(Nf69菌株,ATCC 30215)的抑制活性,进行了三次重复试验,结果以EC50值来评估(图4)。结果显示,除氢原子以外,缺乏任何核心取代基都会得到较差的抑制效果(entry 1, EC50 > 10 μM),无论是顺式或反式环稠合。甲基或氯原子取代R1得到相同的结果。在R2单独取代时(entries 7−11),活性略微改善。氟原子取代使得化合物失活(entries 13−14)。氯原子或三氟甲基取代基的两种非对映体的活性相似,EC50值在大约1-2 μM的范围内(entries 15-18)。氰基取代R2,顺式比反式的活性高3倍(entries 11-12)。三氟甲基取代基取代R3,反式比顺式的活性高7倍(entries 23-24)。氟取代则导致活性丧失。
R2和R3位置的氯取代,活性显著提高(EC50 ~ 200 nM, entries 27−28, 图4)。氯与三氟甲基或甲氧基的结合也观察到类似的结果。一般来说,R2和R3位置的吸电子基团取代,具有更好的活性,尤其是反式异构体。由于Mannich反应在R4位置为氯或溴原子时成功率有限,因此很少有R4取代基的例子。除了苯基取代的衍生物(±)-trans-23b外,所有化合物在高达20 μM的测试浓度下,对神经元细胞均未显示出细胞毒性。
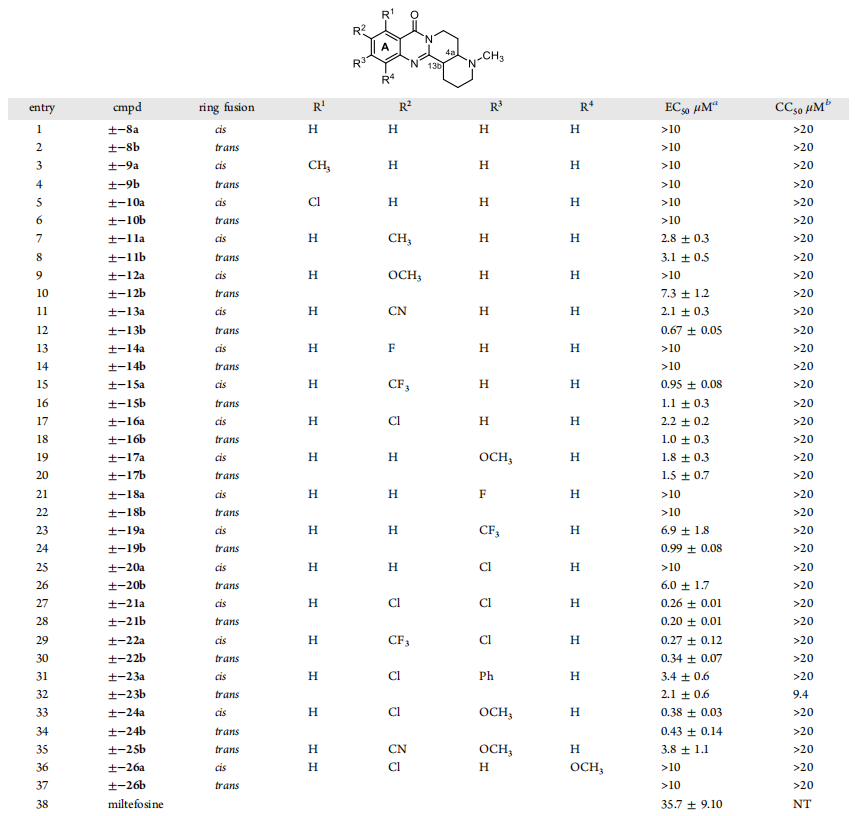
图 4. A环替换及Cis -或Trans - 4a, 13b环稠合对抗阿米巴活性的影响
由于反式异构体通常比相应的顺式异构体收率更高,且六元稠合环类似物在N-脱甲基化反应时(图3,条件a, b),只有反式异构体能够有效地反应,以产生可以进一步衍生化的NH中间体。所以作者使用反式N-甲基产物作为起始材料来研究其他叔胺取代基的影响。二氯喹唑啉酮(±)-trans-21b作为起始骨架(图5)。引入一个异丁基或亚甲基桥连接的环丙基时,分别得到了7 nM和2 nM的EC50值(entries 4-5)。引入亚甲基桥连接的吡啶基团时,EC50值为:3-吡啶≫4-吡啶≫2-吡啶,其中3-吡啶类似物展示了惊人的0.2 nM的EC50值(entry 8)。带有α取代基的N-酰基衍生物失去了活性(entries 11-14),然而,体积较小的(±)-trans-46b则恢复了亚微摩尔级的活性。烷基连接的醇和醚(entries 17-19 和 22-24),有几个显示出个位数的纳摩尔效力范围。作者还对这批类似物进行小鼠微粒体稳定性评估。一些化合物显示出微粒体稳定性,半衰期<60分钟(entries 3-5, 8 , 18-19)。(±)-trans-53b是有效的,并且在测试的类似物中显示出最好的稳定性,半衰期为109分钟,尽管溶解度为40 μM(entry 22)。

图 5. 改变叔胺取代基对(±)反式二氯喹唑啉酮的影响
为进一步优化出溶解度增强和微粒体稳定性的化合物,作者试图替换两个芳香氯原子中的一个。以(±)-trans-53b为起点(图6,entry 10)。将C11位置的氯原子替换为甲氧基,得到了(±)-trans-57b,其EC50值为29 nM,溶解度为198 μM,微粒体稳定性半衰期>145分钟。作者使用手性超临界流体色谱法(supercritical fluid chromatography, SFC)成功分离了(±)-trans-57b的对映异构体。trans-57-ent-2显示出比其他异构体强41倍的效力(EC50 = 12 nM, 图6, entry 13),与外消旋体相比,溶解度和微粒体稳定性有所降低。通过单晶X射线晶体学分析,得到了异构体的绝对构型,trans-57b-ent-1(BDGR-20236)具有4aR, 13bS构型,trans-57b-ent-2(BDGR-20237)具有4aS, 13bR构型(图7)。
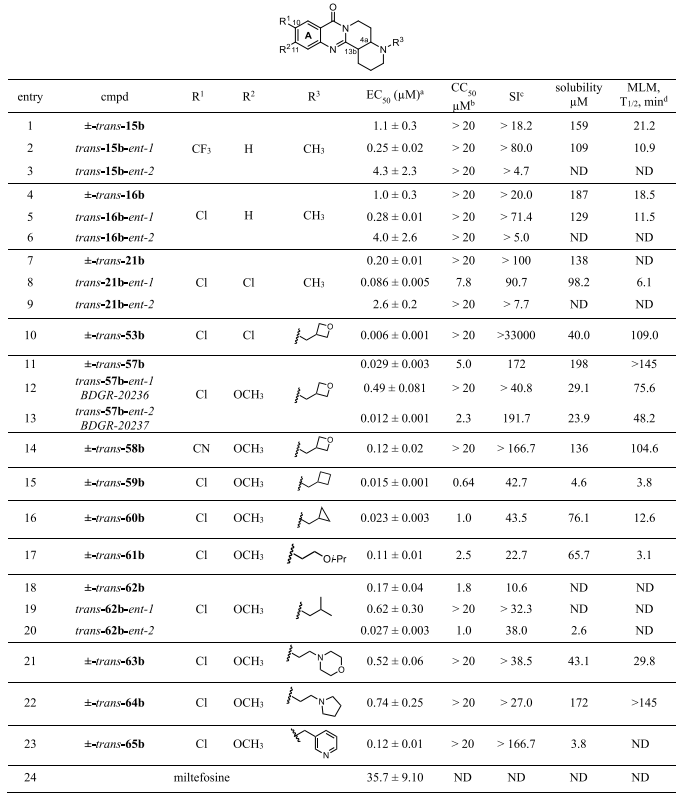
图 6. A环取代和叔胺取代基对效力、溶解度和微粒体稳定性的影响,以及选定的外消旋类似物的分辨率和对映异构体的对比
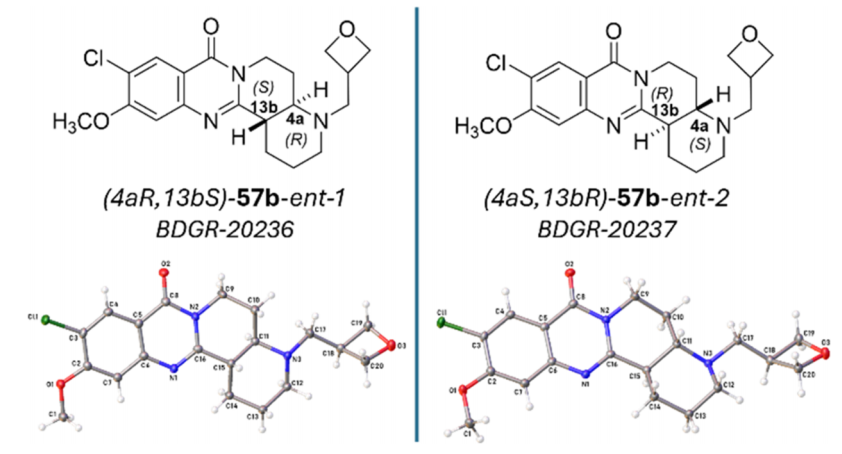
图 7. trans-57b-ent-1和trans-57b-ent-2的X射线衍射图
之后作者评估了trans-57b的两个对映异构体,对从弗吉尼亚州患者体内分离的N. fowleri TY菌株的效力,以评估与Nf69(来源:澳大利亚)相比,在易感性方面的潜在差异(图8)。综合考虑,尽管BDGR-20237在溶解度和代谢稳定性方面不是理想的,但被认为适合进行小鼠药代动力学(PK)研究(图9)。此外作者使用经鼻内感染N. fowleri Nf69的雌性CD-1小鼠评估了BDGR-20237的效力(图10)。结果显示,所有未接受治疗的感染小鼠在实验的第6天死亡。接受两性霉素B治疗的六只小鼠中有两只存活,并表现出正常行为。对两个幸存者的脑组织进行评估,其中一个检测到了阿米巴原虫。两性霉素B治疗组的生存率为17%(图10B)。接受BDGR-20237治疗的感染小鼠在第7天(图10C)死于感染。尽管两个治疗组(即两性霉素B或BDGR治疗的动物)都没有统计学意义上的寿命延长,但与载体对照组相比,两个治疗组都“趋向于”显著性(p>0.1)。作者指出需要进一步的优化,以提高其在体内的稳定性和疗效。
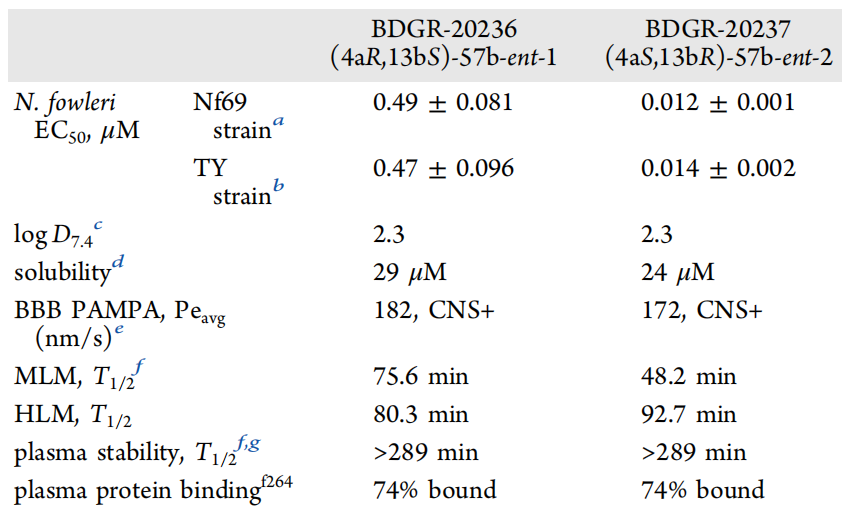
图 8. BDGR-20236和BDGR-20237对两种菌株的效力、物理化学性质和ADME数据

图 9. 在CD-1小鼠中BDGR-20237的PK参数
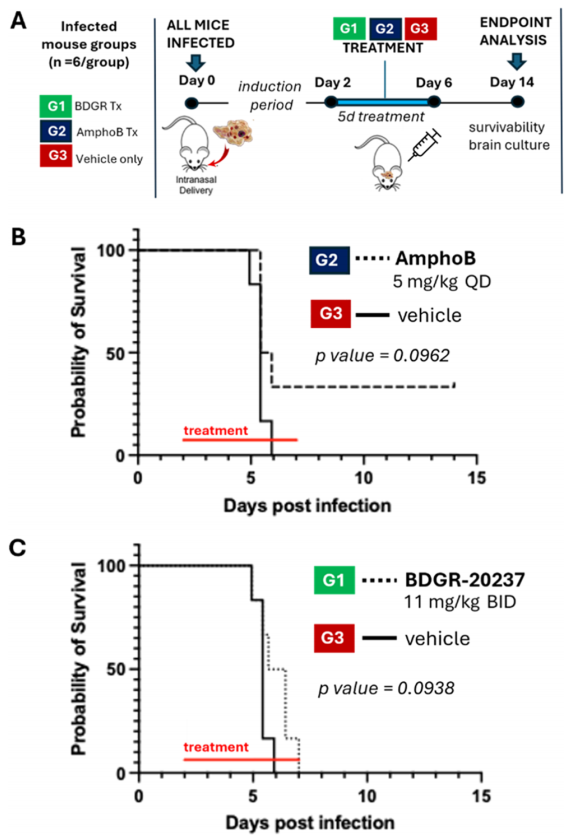
图 10. (A) 使用N. fowleri Nf69进行小鼠效力研究的设计。(B) 用两性霉素B治疗的感染小鼠的Kaplan-Meier生存数据。(C) 用BDGR-20237治疗的感染小鼠的Kaplan-Meier生存数据。
结论
作者采用Mannich偶联的多米诺重排和N-脱甲基化/官能团化过程,得到了88个系列化合物的设计和合成。其中单一对映异构体BDGR-20237对两个野生型N. fowleri菌株表现出了两位数的纳摩尔效力。尽管BDGR-20237在ADME和PK方面存在一些限制,但作者在小鼠感染模型中进行了初步研究,揭示了需要进一步的优化,并需要制定给药频率和持续时间的策略。由于这些化合物是从表型筛选中出现的,目前正在研究以阐明这一化学系列的作用机制。尽管如此,这种新的喹唑啉酮原型代表了一种有前景的开发骨架,它将增强研究者们对N. fowleri脆弱性的理解,从而为新疗法的进步创造机会。
图 11. 实验所用的试剂来自AmBeed等品牌(例如:1122-58-3, A538667; 72287-26-4, A341145; 52409-22-0,A172297; 657408-07-6, A117430等)
DOI:10.1021/acs.jmedchem.4c01630