2024年9月11日,浙江大学药学院顾臻、俞计成课题组和浙江省人民医院叶潇在ACS Nano上发表题为《Glucose-Responsive Microneedle Patch with High Insulin Loading Capacity for Prolonged Glycemic Control in Mice and Minipigs》的研究。设计了一种具有固体胰岛素粉末核心的微针贴片,实现了胰岛素的高负荷能力(>70 wt%),并结合了对葡萄糖敏感的聚合物外壳,实现了葡萄糖响应性胰岛素释放。
研究背景:
糖尿病是一种慢性糖代谢疾病,它影响着全球超过5.37亿人,对血管产生不利影响,并导致严重并发症,包括心血管疾病、肾衰竭和神经损伤。目前1型和晚期2型糖尿病的标准治疗方案是在频繁监测血糖的基础上多次皮下注射胰岛素,以达到血糖正常。不幸的是,这种开环治疗经常导致葡萄糖调节不足或致命的低血糖。此外,这种给药方式还会引起疼痛和感染风险,导致合规性差。为了解决这些问题,研究人员致力于开发“智能”胰岛素给药系统,通过整合葡萄糖传感元件,包括葡萄糖氧化酶(GOx),葡萄糖结合蛋白和苯硼酸(PBA)衍生物,模拟胰腺β细胞的动态胰岛素分泌,特别是在方便安全的给药途径中。微针(MNs)提供了一种理想的经皮给药方式,可以避免胰岛素在消化道中的降解,维持有效的药物浓度,并且具有微创性。传统的微针在胰岛素负荷能力上受限,通常低于6 wt%,这限制了它们在临床应用中的有效性。
研究内容:
本研究设计了一种具有固体胰岛素粉末核心的微针贴片,实现了高胰岛素负荷能力(>70 wt%),并结合了对葡萄糖敏感的聚合物外壳,实现了葡萄糖响应性胰岛素释放(图1)。当暴露于高血糖环境时,葡萄糖与硼酸形成的负电荷复合物增加了外壳基质的电荷密度,导致外壳膨胀并加速胰岛素从核心中释放(图1a)。这些固体微针(Solid-MNs)显著提高胰岛素负荷能力至70%以上,并实现长期血糖控制(图1c)。这种葡萄糖响应性微针贴片在1型糖尿病小鼠和小型猪(体重>25 kg)中实现了长达48小时的血糖水平长期调节。
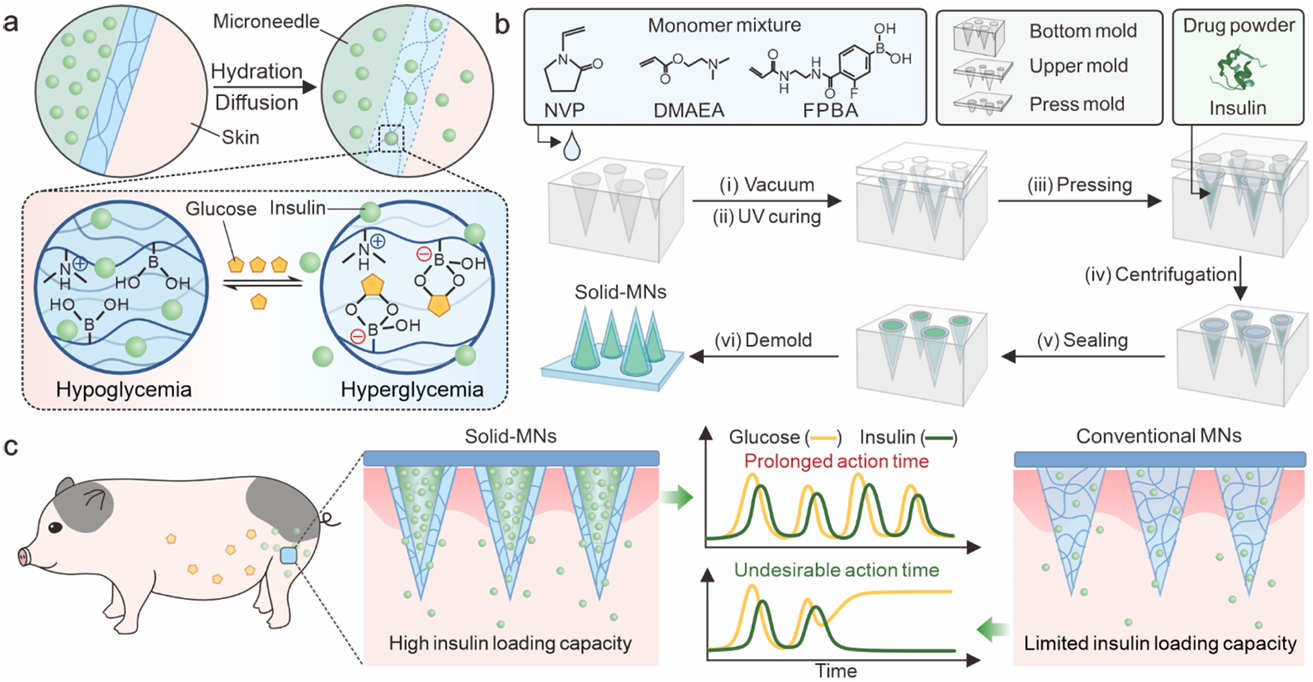
图1 具有葡萄糖响应性和高胰岛素负荷能力的固体微针贴片示意图。a) 葡萄糖诱导胰岛素从固体微针贴片释放的机制,一旦插入皮肤,组织液流经外壳并溶解核心中的胰岛素粉末。随后,溶解的胰岛素通过对葡萄糖敏感的聚合物外壳扩散到皮肤组织中。在高血糖的情况下,硼酸盐部分迅速与葡萄糖结合,形成葡萄糖-硼酸盐复合物,这增加了基质的电荷,导致外壳膨胀,从而促进胰岛素的释放。相反,在低血糖的情况下,聚合物外壳恢复其体积并抑制胰岛素的扩散。b)固体微针贴片的制备工艺示意图。c)与同等大小的传统微针贴片相比,固体微针贴片具有更高的胰岛素负荷能力,可以长时间调节糖尿病小型猪的血糖水平。
固体微针贴片的制备与表征:固体微针由葡萄糖反应壳和固体胰岛素粉末核组成。外壳由N-乙烯基吡咯烷酮(NVP)、N,N′-二甲氨基乙基丙烯酸酯(DMAEA)和(4-((2-丙烯酰胺基乙基)氨基甲酰基)-3-氟苯基)硼酸(FPBA)通过原位聚合形成(图1b)。微针贴片排列成8×8阵列,面积约为0.6 cm²(图2a)。每个微针底部宽度为600 μm,高度为1100 μm,呈圆锥形,微针外壳的厚度为100μm(图2b,c)。通过扫描电子显微镜(SEM)图像(图2c)和共聚焦显微镜图像(图2b)验证了葡萄糖响应微针外壳的空心结构。使用高效液相色谱(HPLC)评估固体微针外壳中残留单体的数量,确保其毒性在安全范围内。虽然单独的Solid-MN壳体的断裂力仅为0.12 N /针,但检测固体微针的断裂力约为0.37 N /针(图2e),足以穿透皮肤。通过光学显微镜和荧光显微镜观察到Solid-MNs中胰岛素的分布情况(图2f)。通过共聚焦显微镜观察固体微针的横截面,可以看到核-壳结构(图2g)。对不同批次制备的固体微针贴片中的5个不同区域的胰岛素负荷进行定量分析,也证实了其分布均匀,重现性好(图2h)。固体微针的胰岛素负荷能力明显大于相同尺寸传统的溶剂蒸发微针(Evap-MNs)(12.0倍)和聚合物微针(Poly-MNs)(2.7倍)(图2i),负荷能力可达71.6%。从固体微针贴片中提取的胰岛素与未经处理的天然胰岛素在生物活性上的差异可以忽略不计(图2j)。此外,固体微针贴片中的胰岛素粉末在室温干燥条件下可以很好地保持至少24周的生物活性(图2k)。
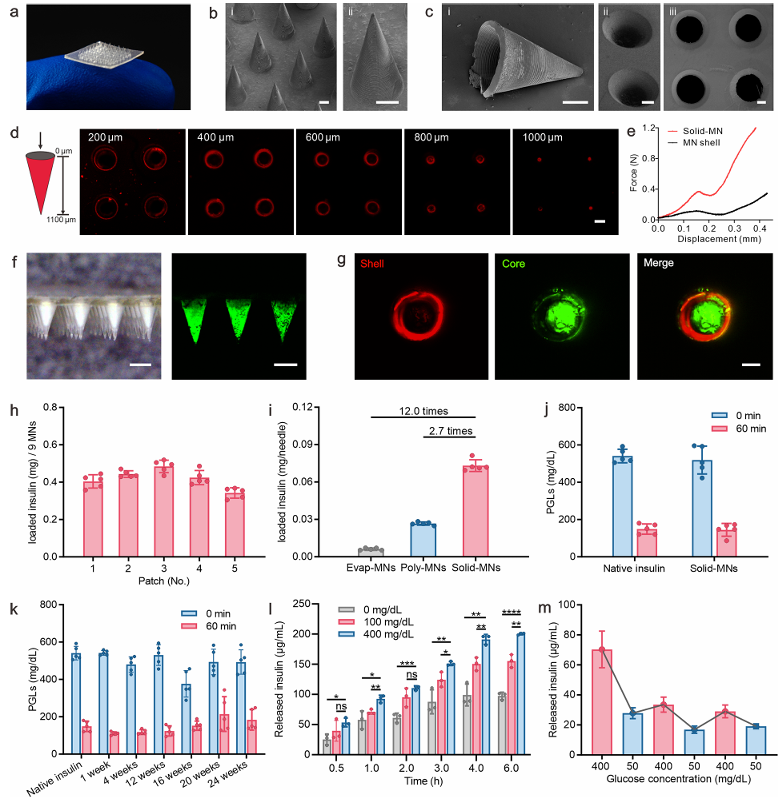
图2 固体微针贴片的制备和表征。a)制备的带有8×8阵列的固体微针贴片的照片。b)代表性的扫描电子显微镜(SEM)图像,包括(i) 固体微针阵列和(ii) 单个固体微针的放大视图。比例尺,200 μm。c)代表性的SEM图像,显示了固体微针的壳层结构,包括(i) 侧面和(ii) 底部视图。(iii) 固体微针的横截面,显示了固体微针的厚度。比例尺,200 μm。d)从底部到顶部观察不同z轴位置的Cy5标记的固体微针壳层的代表性共聚焦图像,比例尺,200 μm。e)固体微针外壳和力学行为。F)负荷胰岛素粉末的固体微针的显微图像(左)和负荷有异硫氰酸荧光素(FITC)标记的胰岛素粉末的固体微针的荧光图像(右)。比例尺,500 μm。g)从横截面视图观察,带有Cy5标记壳层的固体微针和FITC标记的胰岛素负荷内核的共聚焦图像。比例尺,100 μm。h)一个固体微针贴片在5个不同区域中的9个微针中的胰岛素负荷量。i)不同微针中胰岛素负荷量的比较。j)注射天然胰岛素和提取新鲜制备的固体微针中的胰岛素后60分钟,糖尿病小鼠血浆葡萄糖水平(PGLs)的降低。k)室温干燥条件下,从固体微针贴片中提取的胰岛素在糖尿病小鼠体内的长期生物活性。l)在不同葡萄糖浓度下,具有优化外壳的固体微针体外释放胰岛素的情况。m)在葡萄糖浓度为400和50 mg/dL交替变化时,固体微针中胰岛素的脉冲释放。
葡萄糖响应性释放的胰岛素:胰岛素可以通过外壳从固体微针核中释放出来。将固体微针浸入磷酸盐缓冲盐水(PBS)溶液中,溶液流过外壳,将胰岛素粉末溶解在核心中,导致胰岛素进一步通过微针外壳扩散。固体微针释放的葡萄糖响应性胰岛素可归因于不同葡萄糖浓度下聚合物壳的膨胀状态的调节,这主要受两种带电单体FPBA(CAS: 1313712-90-1,A1194179,该产品来自于AmBeed品牌)和DMAEA在壳基质中实现的电荷密度改变的影响。FPBA是一种PBA衍生物,苯环上有两个强吸电子取代基,其pKa值(7.2)较低,比未修饰的PBA基团具有更好的葡萄糖敏感性。带正电荷的DMAEA用于调整聚合物外壳的总电荷。高血糖时,葡萄糖与FPBA的结合增加了壳基质中负电荷的密度,导致壳肿胀,促进胰岛素的释放。固体微针壳中DMAEA与FPBA的不同摩尔比会影响聚合物网络电荷的变化程度,从而导致不同程度的壳膨胀和相关的胰岛素释放速率不同。固体微针壳中带电单体的摩尔比例也可能影响葡萄糖响应性。葡萄糖响应的固体微针壳基质由带反向电荷的单体静电交联而成。作者尝试引入交联剂乙二醇二甲基丙烯酸酯(EGDMA)来构建化学交联的聚合物网络,并研究化学交联对胰岛素释放的影响(详情见原文的支持信息)。
STZ诱导糖尿病小鼠模型中的体内研究:将糖尿病小鼠随机分为4组,分别皮下注射PBS溶液、胰岛素溶液(SC胰岛素,胰岛素剂量0.05 mg)、固体微针(胰岛素剂量3.72 mg)和相同大小的Poly-MNs(胰岛素剂量1.24 mg)。将微针贴片敷于麻醉小鼠背部皮肤(图3a)。SC胰岛素组、固体微针组和等大小Poly-MNs组的PGLs在2 h内均降至200 mg/dL以下。用SC胰岛素处理的小鼠的PGLs在4小时内迅速恢复到高血糖状态,而用固体微针处理的小鼠的PGLs直到35小时才反弹到200 mg/dL,维持正常血糖状态长达34小时(图3b),等大小Poly-MNs的治疗效果维持时间仅为28 小时左右。酶联免疫吸附法(ELISA)对血浆重组胰岛素进行定量分析,结果显示固体微针可持续释放胰岛素(图3c),并进一步阐明其作用时间延长,这最终归因于固体微针中高胰岛素负荷能力。用含有Cy5标记的胰岛素的固体微针贴片给糖尿病小鼠的体内成像显示,固体微针贴片的胰岛素释放持续时间比含有等剂量胰岛素的Poly-MNs更长(图3d,e)。接下来,在固体微针给药3小时后,进行葡萄糖剂量为1.5 g/kg的腹腔注射葡萄糖耐量试验(IPGTT)。在血糖达到峰值后,健康小鼠和固体微针处理小鼠的PGLs分别在10分钟和20分钟恢复到正常血糖水平。相比之下,注射胰岛素溶液的小鼠PGLs短暂下降,随后迅速升高至高血糖(图3f)。在葡萄糖刺激后,固体微针组表现出与健康小鼠组相似的葡萄糖调节能力(图3g)。为了进一步证实体内葡萄糖诱导的胰岛素释放,在固体微针给药3小时后,给予更高剂量的葡萄糖(3g /kg)用于糖尿病小鼠的葡萄糖刺激。血浆胰岛素浓度在PGLs增加后出现明显的峰值,证实了固体微针的葡萄糖响应性(图3h)。在禁食4小时后的6小时内,用Poly-MNs处理的小鼠出现低血糖水平(<50 mg/dL)(图3i)。
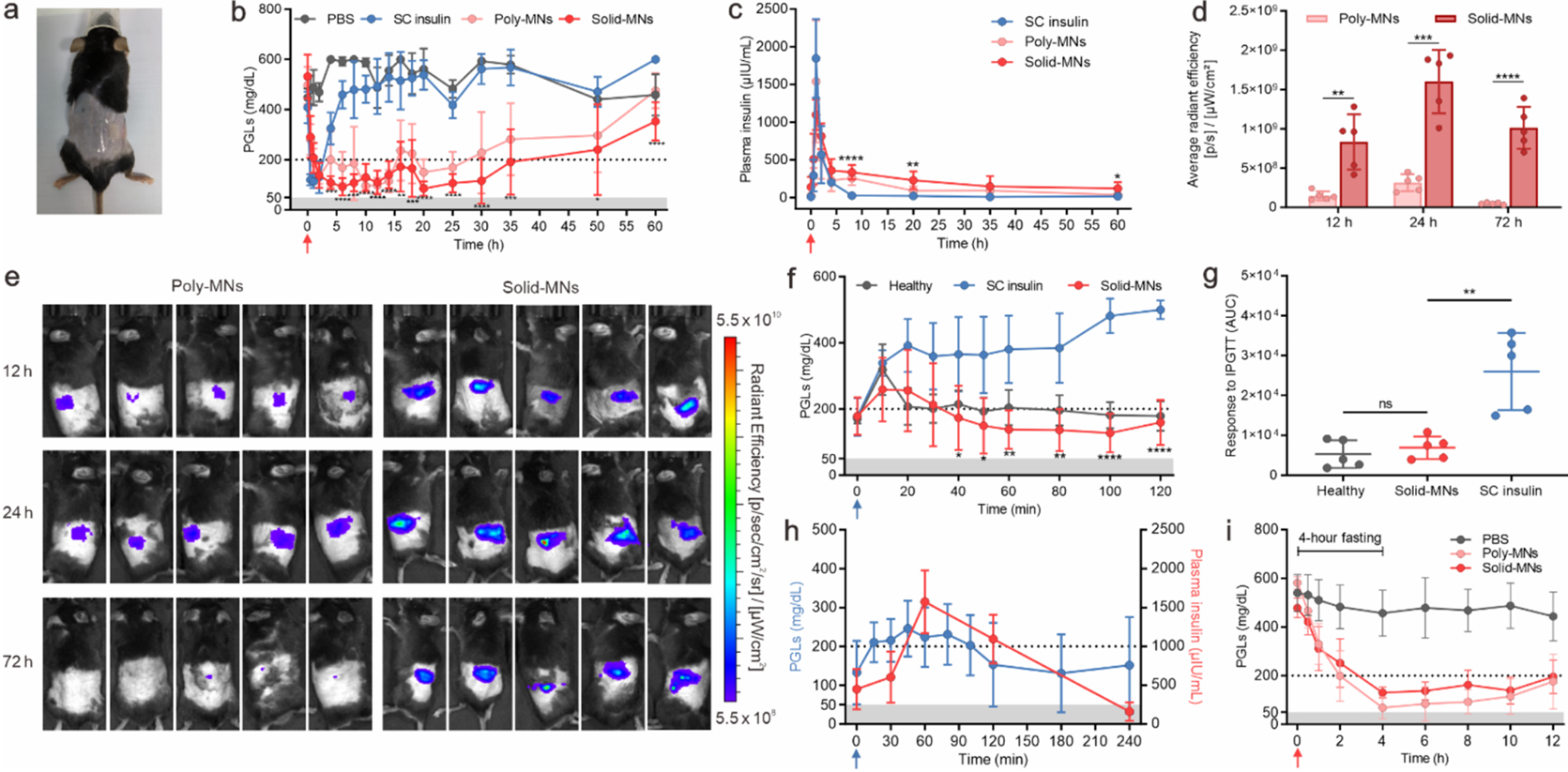
图3 固体微针贴片在糖尿病小鼠模型中的体内研究。
STZ诱导糖尿病小型猪模型的体内研究:作者选择巴马小型猪作为实验的动物模型,是因为它的皮肤结构和成分与人类皮肤相似。STZ诱导的小型猪在后腿部位注射SC胰岛素(0.12 IU/kg)或固体微针贴片(贴片大小:3.5 cm2,胰岛素剂量:22.3 mg)(图4a)。使用Solid-MNs的皮肤冷冻切片显示,Solid-MNs能够穿透小型猪的皮肤(图4b)。采用动态血糖监测系统(CGMS, FreeStyle Libre H, Abbott)监测并记录糖尿病小型猪的血糖水平。与未处理的小型猪组观察到的持续高血糖状态(图4c)相反,使用固体微针贴片治疗的糖尿病小型猪的PGLs在2小时内下降到正常血糖水平,随后在午餐后4小时略有增加,并在第3天早餐后48小时左右波动至200 mg/dL以下的水平(图4e,f)。相反,SC胰岛素组的PGLs在第一次进餐时回升,并在胰岛素给药后8小时超过200 mg/dL(图4d,f)。用固体微针或SC胰岛素治疗后4小时进行口服葡萄糖耐量试验(OGTT)。葡萄糖刺激后,两组小型猪的PGLs均升高。随后,固体微针处理的PGLs下降到原来的正常水平,而SC胰岛素组则升高到高血糖(图4g,h)。进一步进行静脉葡萄糖耐量试验(IVGTT)来验证体内葡萄糖触发的胰岛素释放。如图4i所示,在葡萄糖溶液输注15min,血糖水平达到峰值后,血清胰岛素浓度在45min达到峰值,说明血糖升高促进了胰岛素释放。
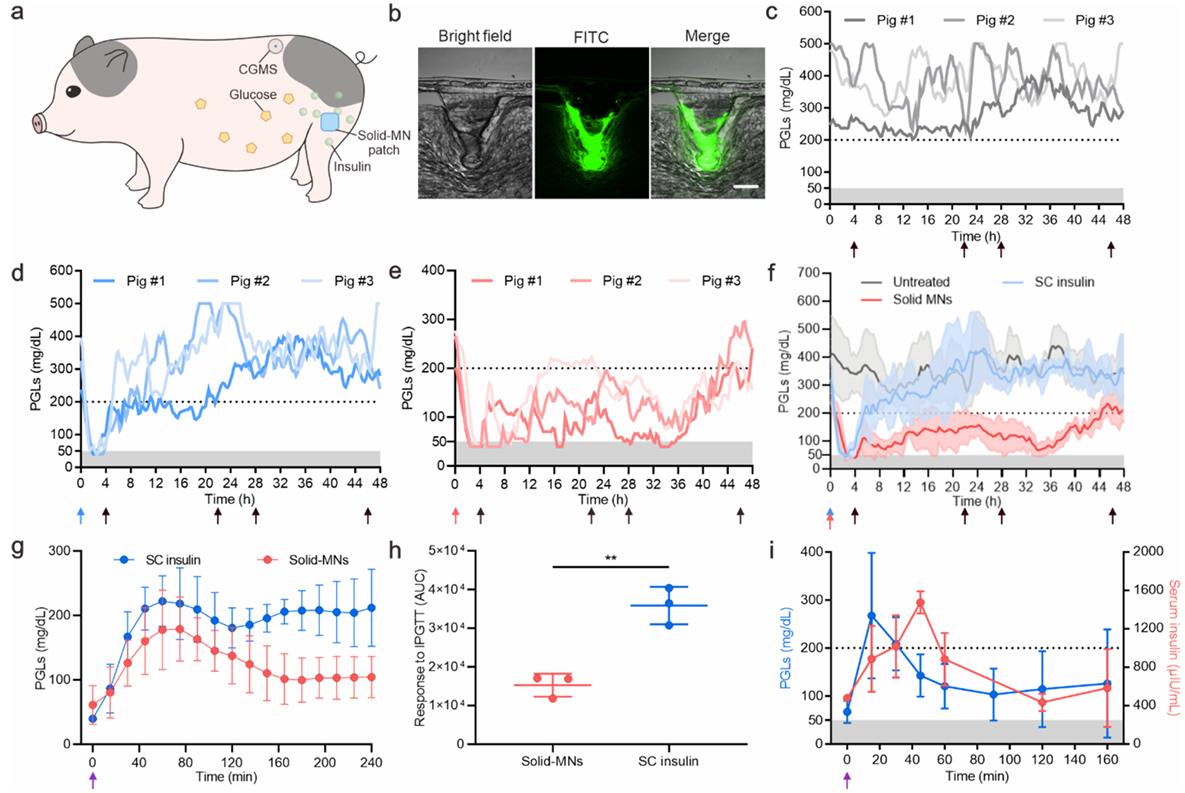
图 4 在 STZ 诱导的糖尿病小型猪模型中对 固体微针贴片进行体内研究。
全文总结:
作者开发了一种葡萄糖敏感的固体微针贴片,其内部空间很大,可以填充胰岛素粉末。与传统的Evap-MNs 和Poly-MNs相比,固体微针贴片以纯粉末的形式封装胰岛素,忽略了在有害溶剂中的溶解度限制,从而实现了一个高胰岛素负荷能力(比Evap-MNs高12.0倍,比Poly-MNs高2.7倍)。此外,由于具有不可降解聚合物外壳的固体纳米颗粒在使用后可以完全去除,因此可以忽略针头物质沉积在皮肤组织中,从而避免了潜在的过敏反应和毒性问题。通过优化各种关键参数,包括DMAEA/FPBA的摩尔比、荷电单体的摩尔比和壳基质中交联剂的重量百分比,使固体微针具有良好的葡萄糖响应性,既能实现快速的葡萄糖响应性,又能延长作用时间,并将低血糖风险降至最低。在STZ诱导的小鼠模型的研究表明,固体微针贴片比相同大小的Poly-MN贴片在正常范围内调节血糖水平的时间更长。在糖尿病小型猪模型(>25 kg)中的进一步研究表明,3.5 cm2大小的固体贴片能够在正常喂养的情况下实现长达48小时的严格血糖控制,这比之前的微针贴片明显更长。进一步的IVGTT结果证实了固体微针在体内葡萄糖刺激的胰岛素释放。

图5 实验中使用的FPBA(CAS:1313712-90-1,A1194179) 来自于 Ambeed
文献链接:https://doi.org/10.1021/acsnano.4c05562








