AmBeed文献解读|JACS
氟苯基自由基的异构体依赖性电子亲和势,•C6H5–xFx (2 ≤ x ≤ 4) 
2024年3月5日,Caroline Chick Jarrold课题组在JACS发表题为《Isomer-Dependent Electron Affinities of Fluorophenyl Radicals, •C6H5–xFx (2 ≤ x ≤ 4)》的文章。
研究背景
苯基自由基的结构和反应性一直是化学研究的热点。苯基由苯环经过均裂C-H键形成,保留了苯的芳香性,具有高度的反应性。环上取代基极大地影响了芳环的反应性和电子结构。最稳定的氟苯基自由基的自由基中心位于氟代碳原子的对位。从热力学的角度来看,任何氟苯(六氟苯例外)形成氟苯基自由基的最低能量路径将再次涉及均裂 C-H 键,因为 C-F 键比 C-H 键强约 0.7 eV。氟苯基取代基与苯基取代基相比,除了提高配体亲和力外,还在新型抗生素耐药性和癌症治疗药物中发挥着重要作用。研究表明,当氟位于苯基取代基的不同位置时,这些药物的功效不同。虽然可以通过相对于氟代碳原子的离去基团位置来控制氟苯基自由基反应物的结构,但碳负离子可能提供另一种方式。
研究内容
二氟苯基、三氟苯基和四氟苯基各具有三种区域异构体,其中几种可以形成多个不同的自由基结构。作者展示了由相关氟苯前体产生的二氟苯、三氟苯和四氟苯区域异构体阴离子的光电子能谱。通过将光电子能谱与密度泛函理论(DFT)计算结果进行比较,对于给定的区域异构体(由 1,2-二氟苯、1,3-二氟苯、1,2,3-三氟苯和1,2,4-三氟苯),最稳定的阴离子对应不太稳定的中性自由基,这表明可以通过电荷状态控制氟苯基上的反应性碳中心。通过对光电子能谱和密度泛函理论计算结果的全面分析,可以进一步了解氟苯基自由基及其相关阴离子的电子和分子结构之间的差异。
使用能够用于阴离子生成、质量选择和光解光谱的装置进行实验。使用 B3LYP/aug-cc-pVTZ 优化了由单个C-H键断裂形成的氟苯基中性自由基和氟苯基阴离子的分子结构。所有计算均使用 Gaussian 16进行。
阴离子光电子能谱
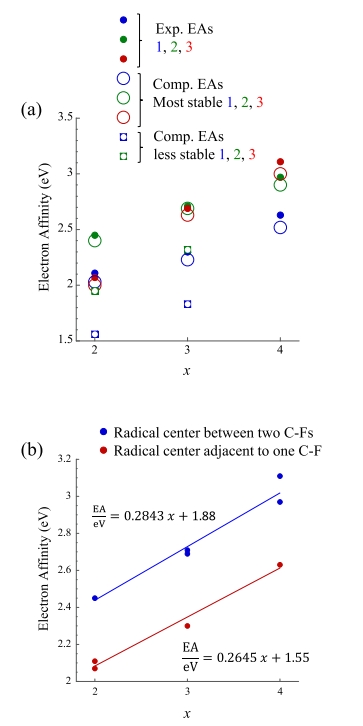
图 1-3 分别显示了由二氟苯、三氟苯和四氟苯前体的三个区域异构体产生的二氟苯基、三氟苯基和四氟苯基自由基的阴离子光电子能谱。使用 3.495 eV 光子能量获得的能谱(蓝色),使用 2.330 eV 光子能量获得的能谱(绿色)。第一组:所有 x 个 F 原子位于相邻的碳原子上。第 2 组: (x − 1) 个 F 原子位于相邻的碳原子上。第 3 组: F 原子最大程度地分离。x 表示氟取代数。指向 e−BE 轴的黑色和红色箭头表示计算的绝热电子亲和能。由 1,2-二氟苯、1,3-二氟苯和 1,4-二氟苯生成的 • C6H3F2 自由基的 EA(电子亲和能)为 2.11 ± 0.10、2.45 eV ± 0.10 和 2.07 ± 0.15 eV。由 1,2,3-三氟苯、1,2,4-三氟苯和 1,3,5-三氟苯生成的 • C6H2F3自由基的 EA 分别为 2.30 ± 0.10、2.71
eV ± 0.10 和 2.69 ± 0.10 eV。由 1,2,3,4-四氟苯、1,2,3,5-四氟苯和 1,2,4,5-四氟苯生成的 • C6HF4 自由基的 EA 分别为 2.63 ± 0.10 eV、2.97 eV ± 0.10 eV 和 3.11 ± 0.10 eV
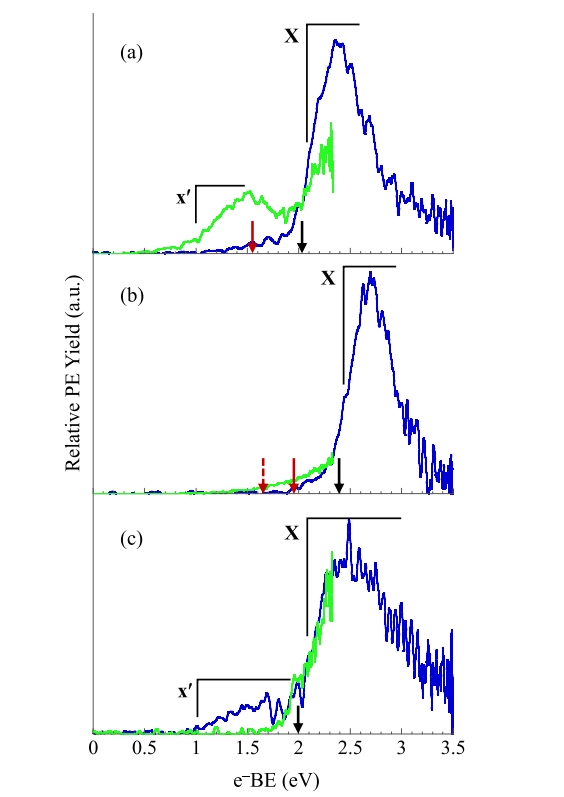
图1. 使用 3.495 eV(蓝色)和 2.33 eV(绿色)获得的(a) 1,2-二氟苯、(b) 1,3-二氟苯和(c) 1,4-二氟苯生成的二氟苯基阴离子的阴离子光电子能谱。
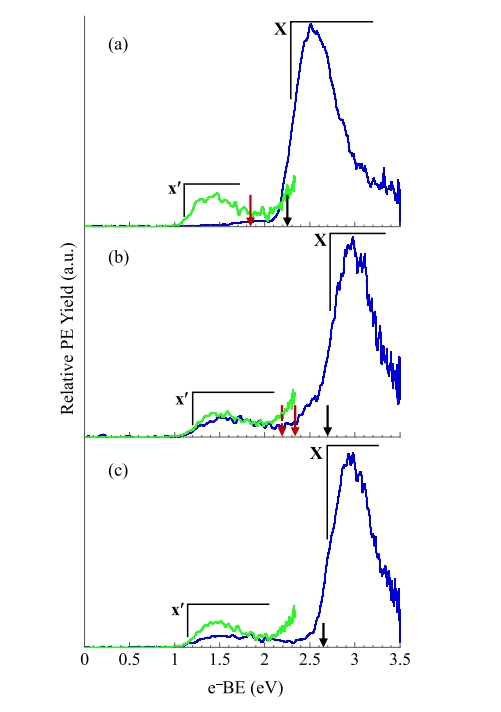
图2. 使用 3.495 eV(蓝色)和 2.33 eV(绿色)获得的(a) 1,2,3-三氟苯、(b) 1,2,4-三氟苯和(c) 1,3,5-三氟苯生成的三氟苯基阴离子的阴离子光电子能谱。
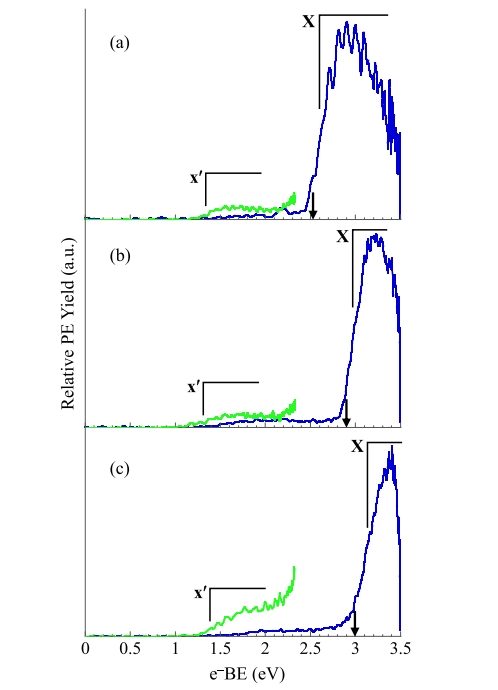
图3. 使用 3.495 eV(蓝色)和 2.33 eV(绿色)获得的(a) 1,2,3,4-四氟苯、(b) 1,2,3,5-四氟苯和(c) 1,2,4,5-四氟苯生成的四氟苯基阴离子的阴离子光电子能谱。
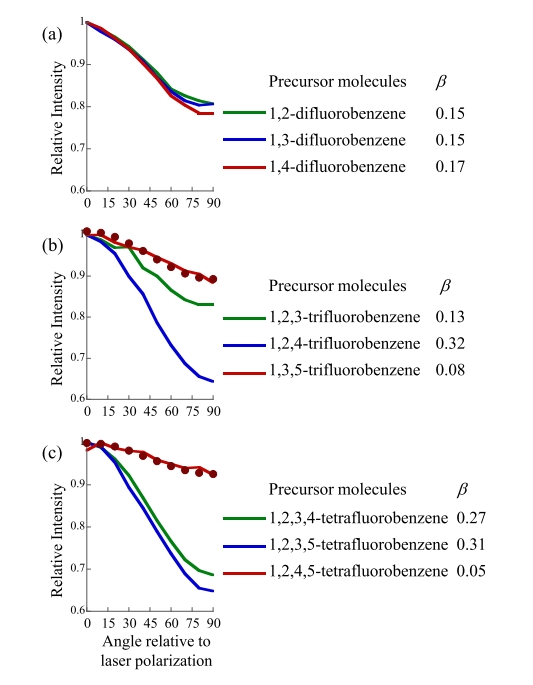
图4. 在 (a) 二氟苯基阴离子、(b) 三氟苯基阴离子和 (c) 四氟苯基阴离子的能谱中,X 带相对于激光偏振或光电子角分布(PAD)的角度的相对强度图。绿色对应于第 1 组,蓝色对应于第 2 组,红色对应于第 3 组。图 (b)、(c) 中的实心红色圆圈遵循将相关的 β 值(例如 0.08 和 0.05)分别代入方程 3 生成。
计算结果
图 5-7 总结了二氟苯、三氟苯和四氟苯的三种区域异构体所形成的所有自由基和相关阴离子的相对能量。1,2-二氟苯前体可以形成两种不同结构的自由基(第 1 组),其中一种自由基中心与氟化碳中心相邻(2,3-二氟苯基),另一种自由基中心相对于氟化碳中心为间位(3,4-二氟苯基),如图 5 所示。前者的能量计算结果比后者高 0.06 eV。阴离子中的能量顺序相反,2,3-二氟苯基阴离子的能量比 3,4-二氟苯基阴离子低 0.41 eV。两种结构的计算 EA 差异为 0.47 eV。
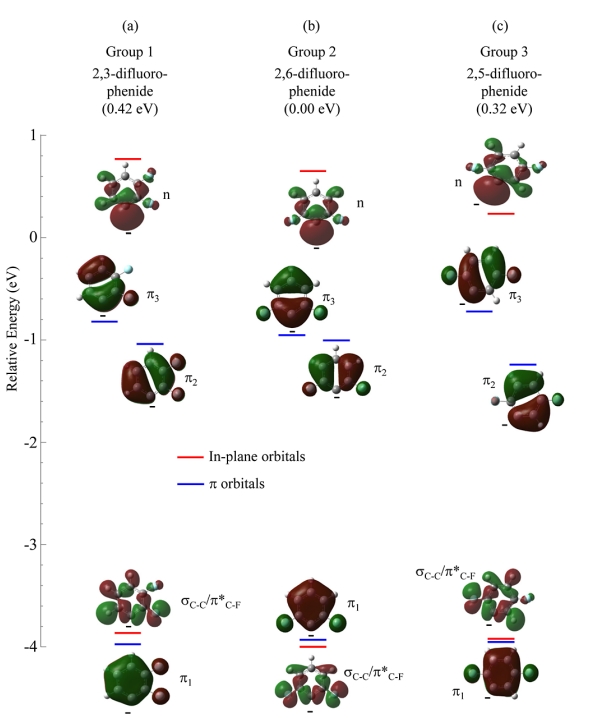
1,3-二氟苯有可能形成的第 2 组中的三种结构。这三种结构中最不稳定的中性自由基是 2,6-二氟苯基自由基,对应最稳定的二氟苯基阴离子。最稳定的中性自由基是 3,5-二氟苯基自由基,对应最不稳定的阴离子。计算得出第 2 组中的三个中性自由基位于 0.25 eV 的能量窗口内,而相关阴离子位于 0.55 eV 的能量窗口内。
1,4-二氟苯只可能形成一种自由基,2,5-二氟苯基自由基和相关阴离子位于 1,3-二氟苯形成中性自由基和阴离子所在的能量窗口内。
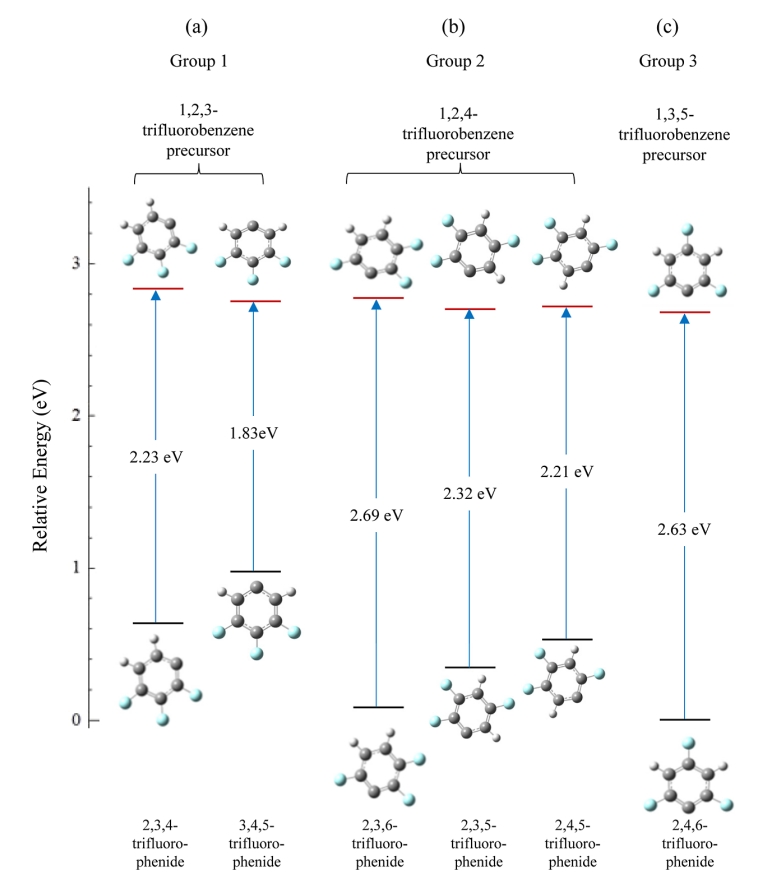
最稳定的中性自由基对应最不稳定的阴离子的情况在三氟苯系列中几乎完全重复,如图 6 所示。
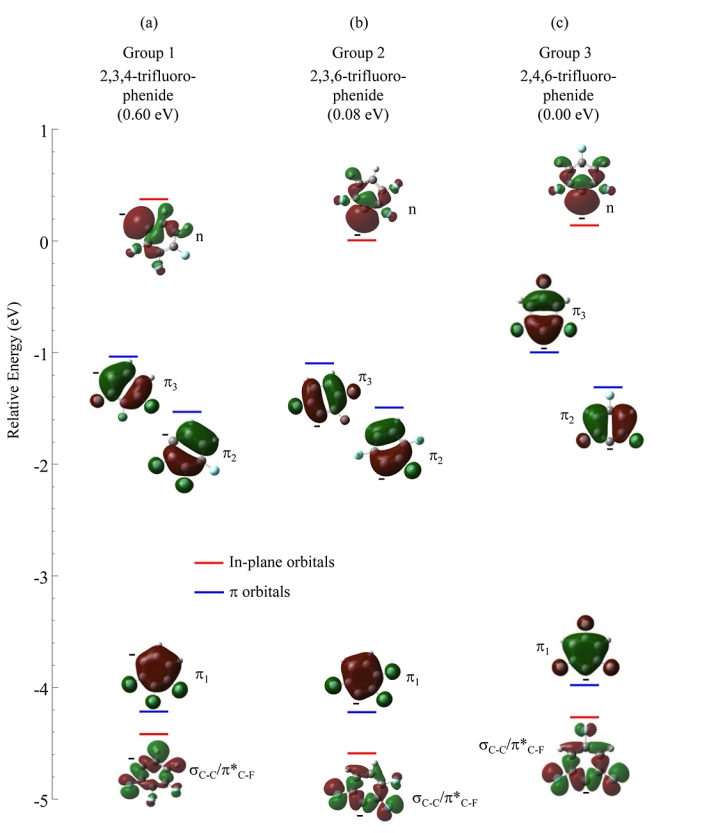
图 7 总结了三种四氟苯基自由基及其各自阴离子的相对能量。对于三种四氟苯异构体,每种都只有一种可能的自由基。经计算,三种中性自由基位于 0.05 eV 的窄能量窗口内,而阴离子的能量窗口范围为 0.54 eV。
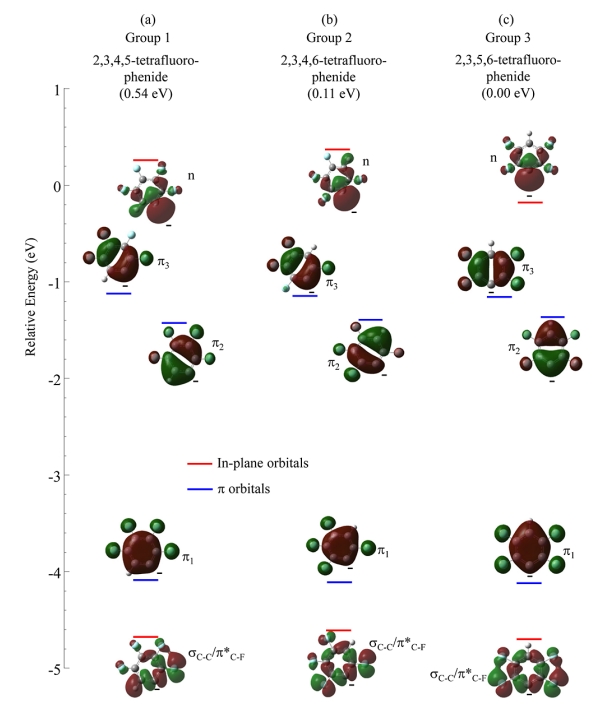
图 8-10 显示了二氟苯(图 8)、三氟苯(图 9)和四氟苯(图 10)这三种区域异构体形成的最低能量阴离子的前线轨道及其计算相对能量。平面内轨道能量用红线表示,平面外 π 轨道能量用蓝线表示。支持信息包含中性自由基的轨道能量。每个阴离子的 HOMO 是碳中心上双占据 sp2 非键合 σ 轨道(标记为“n”),与相关中性自由基中心重合。虽然九种阴离子的 HOMO 在苯环上都略微离域,但 s-p 杂化与介于各向同性和平行之间的 PAD 一致(图 4)。
自由基中心缺电子,而阴离子形成时的同一中心则富电子。氟代碳中心也是缺电子的,这与最低能量自由基结构使 C−F 中心和 • C 中心之间的距离最大化相一致,而阴离子中富电子的碳负中心更倾向于靠近 C−F 中心。当前的研究表明,结构对 EA 的影响程度与氟化程度相当。
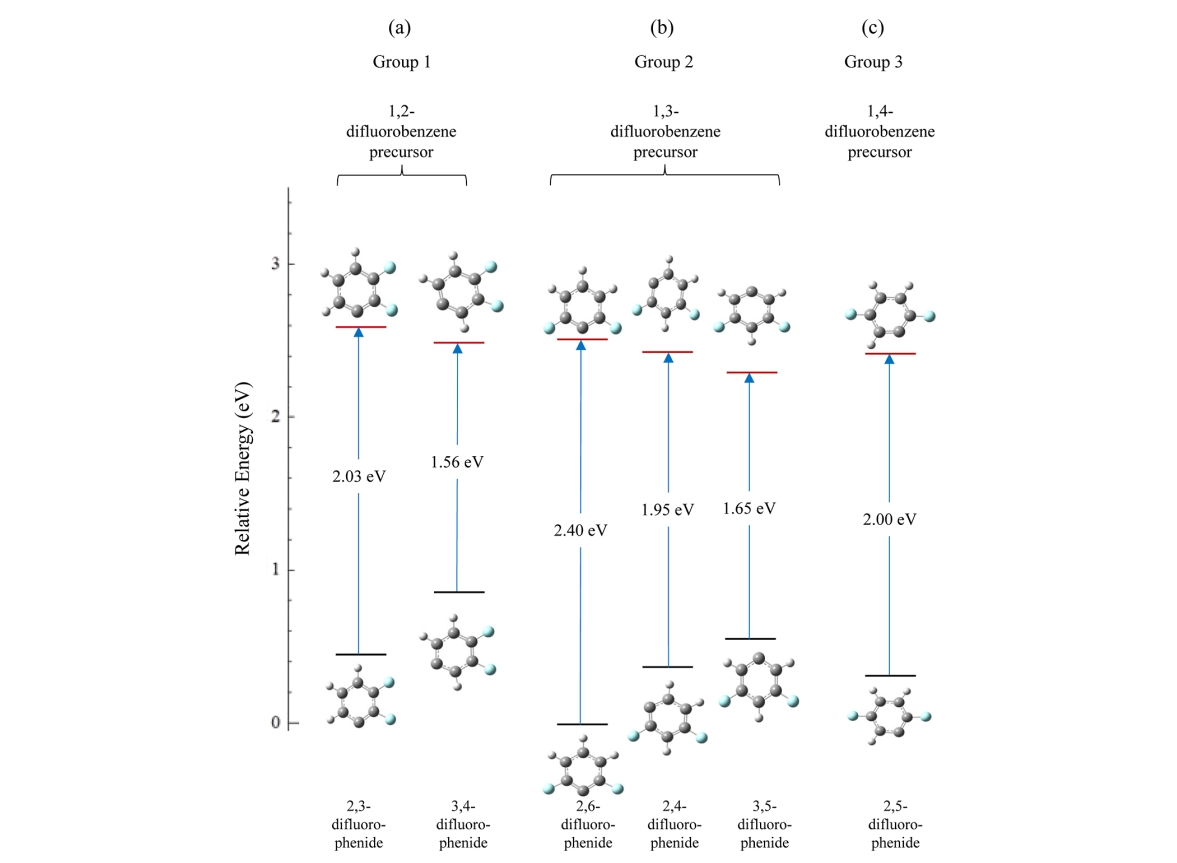
图5. (a) 1,2-二氟苯(第 1 组)、(b) 1,3-二氟苯(第 2 组)和
(c) 1,4-二氟苯(第 3 组)的 C-H 键均裂产生的中性自由基和相关阴离子的相对能量。阴离子指向相关中性自由基的箭头标有计算出的绝热电子亲和能。
图6. (a) 1,2,3-三氟苯(第 1 组)、(b) 1,2,4-三氟苯(第 2 组)和
(c) 1,3,5-三氟苯(第 3 组)的C-H 键断裂产生的中性自由基和相关阴离子的相对能量。阴离子指向相关中性自由基的箭头标有计算出的绝热电子亲和能。
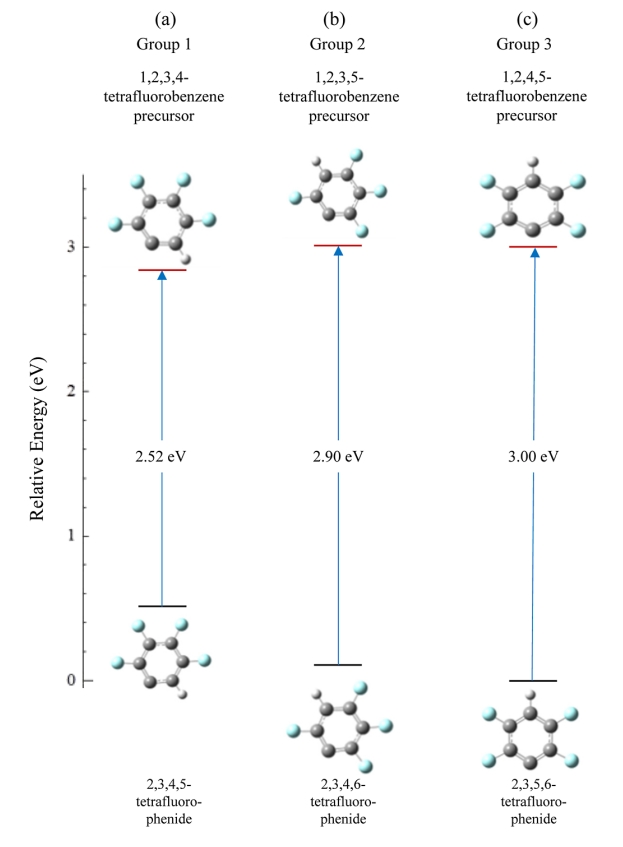
图7. (a) 1,2,3,4-四氟苯(第 1 组)、(b) 1,2,3,5-四氟苯(第 2 组)和
(c) 1,2,4,5-四氟苯(第 3 组)的C-H 键断裂产生的中性自由基和相关阴离子的相对能量。阴离子指向相关中性自由基的箭头标有计算出的绝热电子亲和能。
图8. (a)第 1 组、(b)第 2 组和(c)第 3 组中二氟苯阴离子最低能量结构的价轨道(isovalue = 0.02)的计算结果。
图9. (a)第 1 组、(b)第 2 组和(c)第 3 组中三氟苯阴离子最低能量结构的价轨道(isovalue = 0.02)的计算结果。
图10. (a)第 1 组、(b)第 2 组和(c)第 3 组中四氟苯阴离子最低能量结构的价轨道(isovalue = 0.02)的计算结果。
图11. 与(a)第1组(蓝色)、第2组(绿色)和第3组(红色)中的•C6H5-xFx区域异构体的最稳定阴离子(大空心圆)和第二稳定阴离子(较小的方形符号)相关的自由基计算EA图,作为x的函数。实验值以小实心圆的形式包含在内。(b) •C6H5-xFx区域异构体的实验EA图,其中自由基中心位于两个F取代的碳中心之间(蓝色),自由基中心仅与一个F取代的碳中心相邻(红色),作为x的函数。

实验所用1,2,3-trifluorobenzene(1489-53-8)、1,2,3,4-tetrafluorobenzene(551-62-2)、1,2,3,5-tetrafluorobenzene(2367-82-0)来自AmBeed
结论
本实验给出了由 C6H6−xFx (2 ≤ x ≤ 4) 的三种区域异构体产生的 −C6H5−xFx (2 ≤ x ≤ 4) 氟苯阴离子的阴离子光电子能谱,并将其与阴离子和相关中性自由基的 DFT 计算结果进行了比较。主要发现如下:
1. 最稳定的阴离子与最稳定的中性自由基不对应。因此,阴离子上的反应中心与自由基的反应中心不同,在涉及氟苯加成反应的合成中提供基于电荷态的结构处理。
2. 没有证据表明离子源中发生了苯环上的氟原子重排。
3. 从计算结果来看,与阴离子相比,任何给定 x 形成的多个自由基都位于一个狭窄的能量窗口中。阴离子的能量对过量电荷的敏感程度比氟取代基的位置更高。
4. 根据实验和计算确定,本研究中中性自由基的 EA 与 x 呈线性关系,但自由基中心位于两个氟取代的碳中心之间的自由基的 EA 比自由基中心与一个氟取代的碳中心相邻的自由基高约 0.35 eV。
DOI:http://doi.org/10.1021/jacs.4c00556